配信記事やプレスリリースは、配信・発表元による原稿をそのまま掲載しています。 お問い合わせは各情報配信・発表元に直接お願いします。
グリア細胞での糖代謝促進がアルツハイマー病の治療戦略に!?
1.概要
東京都立大学大学院理学研究科 生命科学専攻の岡 未来子(当時大学院生、現ベイラー医科大学研究員)と安藤香奈絵 教授らの研究グループは、米国ベイラー医科大学との共同研究により、アルツハイマー病などで起きる神経細胞死に対して、神経細胞の働きを調節するグリア細胞内での糖代謝の改善が保護的に働くことを解明しました。
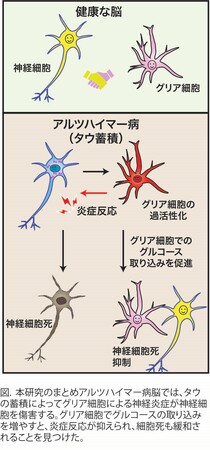
思考や記憶など生物の高次機能を司る脳の働きは、情報処理を担う神経細胞と、全体のメンテナンスを担うグリア細胞によって担われています。アルツハイマー病をはじめとする神経変性疾患の患者の脳内では、それらの細胞のエネルギー源となる糖の取り込みやその代謝が低下しており、神経細胞の糖代謝低下が神経機能を低下させる原因と考えられています。しかし、グリア細胞の糖代謝の疾患への関わりについてはよくわかっていませんでした。本研究では、アルツハイマー病など、認知症の原因となる疾患で神経細胞死を引き起こすタンパク質「タウ」を発現させたショウジョウバエモデルを用いて、グリア細胞の変化を解析しました。タウの発現によって、視神経細胞死が起こりますが、この時グリア細胞は、一部消失したり、神経細胞を傷害する過剰な炎症反応を起こしていることを見つけました。そして、グリア細胞での糖の取り込みを増やすと、過剰な炎症は緩和され、神経細胞死も抑えられることがわかりました(図)。
【画像:https://kyodonewsprwire.jp/img/202504157402-O1-fxTIK2J3】
2.ポイント
・ショウジョウバエの眼で、アルツハイマー病などの原因となるタンパク質タウによる神経細胞死のメカニズムを調べた。
・タウを発現する組織では、視神経細胞が死ぬと同時に、グリア細胞による貪食作用と炎症が活性化していた。
・グリア細胞での糖の取り込みの促進により、グリア細胞の炎症反応が抑制され、視神経細胞死が抑えられた。
3.研究の背景
超高齢化を迎え、認知症の予防、診断、治療法の確立は、世界中で喫緊の課題となっています。老年性認知症の主たる疾患であるアルツハイマー病をはじめ多くの神経変性疾患は、タウなどの異常なタンパク質が蓄積することで、神経細胞が次々と死んでいく病気です。脳を構成する細胞のうち、神経細胞以外の大部分を占めるグリア細胞は、脳の中での免疫機能を担っています。異常なタンパク質の蓄積に応答してそれらを除去するという保護的な機能を担う一方で、その過活性化は神経炎症を引き起こし、病態を悪化させる両義的な性質を持っています。
アルツハイマー病患者の脳内ではエネルギー源となる糖(グルコース)の代謝が低下していることがわかっています。神経細胞は多くのエネルギーを必要とし、その原料を糖に依存しています。そこで、糖代謝の低下が、アルツハイマー病の発症に関わると考えられてきました。しかし、グリア細胞での糖代謝と疾患への関わりはよくわかっていませんでした。
アルツハイマー病などの複雑な疾患を理解するために、ショウジョウバエはモデル動物として大きく貢献してきました。ヒトのタウをショウジョウバエの眼に発現させると、視神経細胞死が起こります。この時のグリア細胞の変化を解析し、さらに糖代謝の役割を調べました。
4.研究の詳細
まず、ヒトのタウを視神経系細胞に発現させたショウジョウバエを観察したところ、視神経細胞死に加えて、グリア細胞の貪食によって形成された異常タンパク質の封入体が見られました。 また、免疫関連遺伝子の劇的な発現上昇から、グリア細胞の過剰な活性化が示されました。さらに視神経系組織の一部は膨張していましたが、この部分ではグリア細胞が消滅していました。
次に、これらのタウによる異常が糖代謝を促進することで緩和できるかを検討しました。糖代謝を促進するために、細胞内へのグルコースの取り込みに必要なトランスポーター(GLUT)をタウと共発現させたところ、視神経系組織の異常形態と細胞死が有意に抑制されました。グルコースの取り込みを増やした際、タウ自体の量には変化はなかったことから、グルコース取り込みの促進による保護的な効果は、タウ自体には影響を与えず、タウに対する細胞の反応を変化させていることが示唆されました。
さらに、GLUTを視神経細胞、グリア細胞それぞれについて発現させることで、どちらの細胞種でのグルコース取り込みが視神経細胞死に影響しているのかを調べました。遺伝学的手法でグリア細胞特異的にGLUTを発現させると、グリア細胞の過剰な活性化を正常個体と同じ程度まで下げることができました。さらに、グリア細胞でのGLUT発現は、視神経細胞死を抑制しました。これらより、グリア細胞での糖代謝の促進は、過剰な免疫反応を抑え、タウによる神経細胞死を緩和できることがわかりました。
本研究は、米国ベイラー医科大学との共同研究で行われました。また本研究は、独立行政法人 日本学術振興会、文部科学省 科学研究費助成事業、長寿科学振興財団、大学共同利用機関法人 情報・システム研究機構 国立遺伝学研究所、武田科学振興財団、米国NIA/NIH、東京都立大学による資金援助を受けて実施されました。
5.研究の意義と波及効果
脳の糖代謝は加齢とともに低下し、加齢はアルツハイマー病など神経変性疾患のリスクを増加させます。今回の発見から、グリア細胞での糖代謝の変化が、神経変性疾患の発症機構に関わることが示唆されました。また、脳内の炎症反応はアルツハイマー病だけでなく、パーキンソン病など多くの神経変性疾患で、疾患の進行に関与していると考えられています。本研究から、グリア細胞の糖代謝を促進することで、アルツハイマー病などで神経細胞を傷害する神経炎症を緩和できる可能性が示唆されました。グリア細胞内の糖代謝促進を創薬標的とした、神経変性疾患の予防、または病気の進行を遅らせる戦略の開発につながると期待されます。
(論文情報)
<タイトル> Glucose uptake in pigment glia suppresses tau-induced inflammation and photoreceptor degeneration in Drosophila
<著者名> Mikiko Oka, Sho Nakajima, Emiko Suzuki, Shinya Yamamoto, Kanae Ando
<雑誌名> Disease Models and Mechanisms
<DOI> 10.1242/dmm.052057
プレスリリース詳細へ https://kyodonewsprwire.jp/release/202504157402
東京都立大学大学院理学研究科 生命科学専攻の岡 未来子(当時大学院生、現ベイラー医科大学研究員)と安藤香奈絵 教授らの研究グループは、米国ベイラー医科大学との共同研究により、アルツハイマー病などで起きる神経細胞死に対して、神経細胞の働きを調節するグリア細胞内での糖代謝の改善が保護的に働くことを解明しました。
思考や記憶など生物の高次機能を司る脳の働きは、情報処理を担う神経細胞と、全体のメンテナンスを担うグリア細胞によって担われています。アルツハイマー病をはじめとする神経変性疾患の患者の脳内では、それらの細胞のエネルギー源となる糖の取り込みやその代謝が低下しており、神経細胞の糖代謝低下が神経機能を低下させる原因と考えられています。しかし、グリア細胞の糖代謝の疾患への関わりについてはよくわかっていませんでした。本研究では、アルツハイマー病など、認知症の原因となる疾患で神経細胞死を引き起こすタンパク質「タウ」を発現させたショウジョウバエモデルを用いて、グリア細胞の変化を解析しました。タウの発現によって、視神経細胞死が起こりますが、この時グリア細胞は、一部消失したり、神経細胞を傷害する過剰な炎症反応を起こしていることを見つけました。そして、グリア細胞での糖の取り込みを増やすと、過剰な炎症は緩和され、神経細胞死も抑えられることがわかりました(図)。
【画像:https://kyodonewsprwire.jp/img/202504157402-O1-fxTIK2J3】
2.ポイント
・ショウジョウバエの眼で、アルツハイマー病などの原因となるタンパク質タウによる神経細胞死のメカニズムを調べた。
・タウを発現する組織では、視神経細胞が死ぬと同時に、グリア細胞による貪食作用と炎症が活性化していた。
・グリア細胞での糖の取り込みの促進により、グリア細胞の炎症反応が抑制され、視神経細胞死が抑えられた。
3.研究の背景
超高齢化を迎え、認知症の予防、診断、治療法の確立は、世界中で喫緊の課題となっています。老年性認知症の主たる疾患であるアルツハイマー病をはじめ多くの神経変性疾患は、タウなどの異常なタンパク質が蓄積することで、神経細胞が次々と死んでいく病気です。脳を構成する細胞のうち、神経細胞以外の大部分を占めるグリア細胞は、脳の中での免疫機能を担っています。異常なタンパク質の蓄積に応答してそれらを除去するという保護的な機能を担う一方で、その過活性化は神経炎症を引き起こし、病態を悪化させる両義的な性質を持っています。
アルツハイマー病患者の脳内ではエネルギー源となる糖(グルコース)の代謝が低下していることがわかっています。神経細胞は多くのエネルギーを必要とし、その原料を糖に依存しています。そこで、糖代謝の低下が、アルツハイマー病の発症に関わると考えられてきました。しかし、グリア細胞での糖代謝と疾患への関わりはよくわかっていませんでした。
アルツハイマー病などの複雑な疾患を理解するために、ショウジョウバエはモデル動物として大きく貢献してきました。ヒトのタウをショウジョウバエの眼に発現させると、視神経細胞死が起こります。この時のグリア細胞の変化を解析し、さらに糖代謝の役割を調べました。
4.研究の詳細
まず、ヒトのタウを視神経系細胞に発現させたショウジョウバエを観察したところ、視神経細胞死に加えて、グリア細胞の貪食によって形成された異常タンパク質の封入体が見られました。 また、免疫関連遺伝子の劇的な発現上昇から、グリア細胞の過剰な活性化が示されました。さらに視神経系組織の一部は膨張していましたが、この部分ではグリア細胞が消滅していました。
次に、これらのタウによる異常が糖代謝を促進することで緩和できるかを検討しました。糖代謝を促進するために、細胞内へのグルコースの取り込みに必要なトランスポーター(GLUT)をタウと共発現させたところ、視神経系組織の異常形態と細胞死が有意に抑制されました。グルコースの取り込みを増やした際、タウ自体の量には変化はなかったことから、グルコース取り込みの促進による保護的な効果は、タウ自体には影響を与えず、タウに対する細胞の反応を変化させていることが示唆されました。
さらに、GLUTを視神経細胞、グリア細胞それぞれについて発現させることで、どちらの細胞種でのグルコース取り込みが視神経細胞死に影響しているのかを調べました。遺伝学的手法でグリア細胞特異的にGLUTを発現させると、グリア細胞の過剰な活性化を正常個体と同じ程度まで下げることができました。さらに、グリア細胞でのGLUT発現は、視神経細胞死を抑制しました。これらより、グリア細胞での糖代謝の促進は、過剰な免疫反応を抑え、タウによる神経細胞死を緩和できることがわかりました。
本研究は、米国ベイラー医科大学との共同研究で行われました。また本研究は、独立行政法人 日本学術振興会、文部科学省 科学研究費助成事業、長寿科学振興財団、大学共同利用機関法人 情報・システム研究機構 国立遺伝学研究所、武田科学振興財団、米国NIA/NIH、東京都立大学による資金援助を受けて実施されました。
5.研究の意義と波及効果
脳の糖代謝は加齢とともに低下し、加齢はアルツハイマー病など神経変性疾患のリスクを増加させます。今回の発見から、グリア細胞での糖代謝の変化が、神経変性疾患の発症機構に関わることが示唆されました。また、脳内の炎症反応はアルツハイマー病だけでなく、パーキンソン病など多くの神経変性疾患で、疾患の進行に関与していると考えられています。本研究から、グリア細胞の糖代謝を促進することで、アルツハイマー病などで神経細胞を傷害する神経炎症を緩和できる可能性が示唆されました。グリア細胞内の糖代謝促進を創薬標的とした、神経変性疾患の予防、または病気の進行を遅らせる戦略の開発につながると期待されます。
(論文情報)
<タイトル> Glucose uptake in pigment glia suppresses tau-induced inflammation and photoreceptor degeneration in Drosophila
<著者名> Mikiko Oka, Sho Nakajima, Emiko Suzuki, Shinya Yamamoto, Kanae Ando
<雑誌名> Disease Models and Mechanisms
<DOI> 10.1242/dmm.052057
プレスリリース詳細へ https://kyodonewsprwire.jp/release/202504157402