【東京医科大学】母胎内低酸素環境が新生仔マウスの海馬形成に及ぼす影響を解明(社会人大学院生、医学科リサーチ・コース学生が発見)
東京医科大学(学長:宮澤啓介/東京都新宿区)組織・神経解剖学分野(髙橋宗春主任教授)の大山恭司准教授らの研究グループが、母胎内低酸素環境が新生仔マウスの海馬形成に及ぼす影響を解明しました。本研究では、同大社会人大学院生の大村捷一郎(精神医学分野専攻医)、同大医学科第4学年の小川莉奈、同大医学科第6学年の嘉和知朋美らが共同筆頭著者を務めています。本研究には、篠原広志講師、他の医学科学生も参加し、大阪大学の前田秀将准教授と共同で行われました。
本研究成果は、2024年10月17日、国際神経科学専門誌「Frontiers in Cellular Neuroscience」に掲載されました。
【概要】
東京医科大学(学長:宮澤啓介/東京都新宿区)組織・神経解剖学分野(髙橋宗春主任教授)の大山恭司准教授らの研究グループが、母胎内低酸素環境が新生仔マウスの海馬形成に及ぼす影響を解明しました。本研究では、同大社会人大学院生の大村捷一郎(精神医学分野専攻医)、同大医学科第4学年の小川莉奈、同大医学科第6学年の嘉和知朋美らが共同筆頭著者を務めています。本研究には、篠原広志講師、他の医学科学生も参加し、大阪大学の前田秀将准教授と共同で行われました。
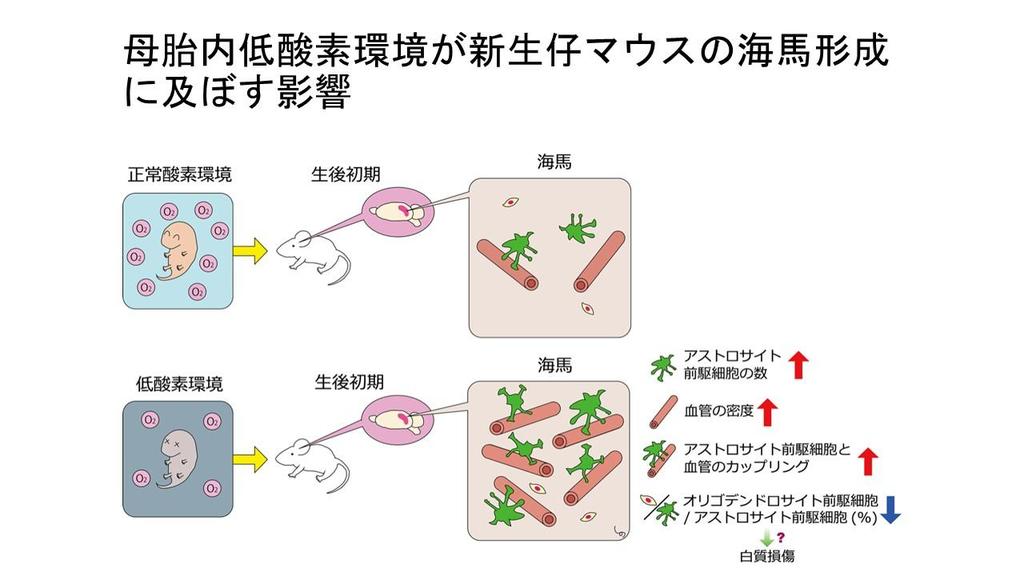
海馬は学習や記憶を司る脳部位で、低酸素環境で損傷を受けやすいことが知られています。研究の結果、低酸素環境への適応として、海馬内の新規アストロサイト前駆細胞が増加し、血管とのつながりが強化されることが判明しました。一方で、オリゴデンドロサイト前駆細胞の比率が顕著に低下し、白質損傷のリスクが高まる可能性も示唆されました。
本研究成果は、2024年10月17日、国際神経科学専門誌「Frontiers in Cellular Neuroscience」に掲載されました。
【本研究のポイント】
● 胎生後期から生後発達期にかけて、Olig2、NG2、BLBPを共発現する新規アストロサイト前駆細胞(Olig2+/NG2+/BLBP+ ASPs)が発生する。
● 妊娠時睡眠時無呼吸症候群モデルマウスから生まれた仔マウスでは、上記のOlig2+/NG2+/BLBP+ ASPsおよびミクログリアが増生し、それらの血管カップリングが促進される。
● 同モデルマウスから生まれた仔マウスにおいて、GFAP陽性アストロサイトの細胞数は変化しないが、血管カップリングが促進された。
● 同モデルマウスから生まれた仔マウスにおいて、オリゴデンドロサイト前駆細胞/アストロサイト前駆細胞の比率が低下することが明らかとなった。
● 以上の結果から、1)Olig2+/NG2+/BLBP+ ASPsは神経血管ユニットを構成する新規細胞である、2)同ASPsはGFAP+アストロサイトとは異なる様式で低酸素環境に適応することで神経血管ユニットの機能を増強することが示唆された。またオリゴデンドロサイト前駆細胞 vs. アストロサイト前駆細胞の比率低下は、低酸素環境への適応による代償と考えられる。
【研究の背景】
学習・記憶を司る海馬は、低酸素環境下で損傷を受けやすい脳部位として知られています。しかし、出生前に低酸素環境に曝露されたマウス海馬にどのような組織学的変化が起きるかは明らかではありませんでした。
【本研究で得られた結果・知見】
本研究は、妊娠時睡眠時無呼吸症候群モデルマウスから生まれた仔マウスでは、私たちが独自に発見した新規アストロサイト前駆細胞(Olig2+/NG2+/BLBP+ ASPs)が増生し、それらの血管カップリングが増進します。その一方で、上記アストロサイト前駆細胞に対するオリゴデンドロサイト前駆細胞の比率が低下することを見出しました。アストロサイト/オリゴデンドロサイト比率のアンバランスは白質損傷との関連性が示唆されています。今後、低酸素環境が白質の形成に及ぼす影響を明らかにする必要があります。
【今後の研究展開および波及効果】
本研究成果は、母胎環境が新生児の学習能力や記憶力の発達にどう影響するか、海馬も含め脳がどのように環境変化に適応して自己を守るかを明らかにするための手がかりとなります。将来的には、発達障害の早期発見や効果的な介入方法を開発することが期待されます。
【論文情報】
タイトル:Olig2+/NG2+/BLBP+ astrocyte progenitors: A novel component of the neurovascular unit in the developing mouse hippocampus
著 者: Shoichiro Omura , Rina Ogawa , Tomomi Kawachi , Aya Ogawa , Yuuki Arai , Natsumi Takayama , Aki Masui , Kumiko Kondo , Hiroki Sugimoto , Hiroshi M Shinohara , Tokiharu Takahashi , Hideyuki Maeda* and Kyoji Ohyama **
(太字:Equal Contribution / *:責任著者 /**:責任著者、Leading contact)
掲載誌名:Frontiers in Cellular Neuroscience
DOI:10.3389/fncel.2024.1464402
【主な競争的研究資金】
本研究は、三井住友海上福祉財団 (to KO)、日本学術振興会科研費:22H03367 (to KO), 23 K05995 (to KO), 16 K18983 (to HS), and 20 K07233 (to HS)、東京医科大学ダイバーシティ推進センター:TMUCD-202202, TMUCD-202301, TMUCD-202409 (to HS)、東京医科大学・学長裁量研究費(to KO)の支援を受けて行われました。
▼本件に関する問い合わせ先
企画部 広報・社会連携推進室
住所:〒160-8402 東京都新宿区新宿6-1-1
TEL:03-3351-6141(代)
メール:d-koho@tokyo-med.ac.jp
【リリース発信元】 大学プレスセンター https://www.u-presscenter.jp/
プレスリリース詳細へ https://digitalpr.jp/r/97393