パーキンソン病治療薬による意思決定障害に関わる神経メカニズムの解明
〜 なぜ不合理な選択をしてしまうのか 〜
意思決定とは複数の選択肢から最適なものを選ぶ行為であり、ヒトの日常生活において重要な脳の働きです。食事、交通、買い物、金銭管理など様々な場面で意思決定を行いますが、時には暴飲暴食、浪費といった不合理な選択をしてしまうこともあります。持続的に不合理な選択をしてしまう状態を意思決定障害といいます。パーキンソン病治療薬を服用している患者さんでは、副作用として意思決定障害が高い頻度で認められ、治療を進めるうえで大きな問題となっています。しかしながら、パーキンソン病治療薬による意思決定障害の詳細なメカニズムは十分にわかっていませんでした。
藤田医科大学 精神・神経病態解明センター 神経行動薬理学研究部門の永井拓教授、窪田悠力助教と医学部 脳神経内科学の渡辺宏久教授らの研究グループは、ヒトにおいて意思決定能力の評価に用いられているアイオワギャンブリング課題※1をマウスの行動実験に応用し、淡蒼球外節※2と呼ばれる脳領域の活動亢進がパーキンソン病治療薬による意思決定障害に関わることを明らかにしました。本研究成果により、淡蒼球外節を標的とした意思決定障害の新しい予防薬や治療薬の開発につながることが期待されます。
本研究成果は、国際学術誌「International Journal of Molecular Sciences」(2024年8月14日)に掲載されました。
論文URL : https://www.mdpi.com/1422-0067/25/16/8849
<研究成果のポイント>
パーキンソン病モデルマウスを用いた実験で、パーキンソン病治療薬による意思決定障害をタッチスクリーン式アイオワギャンブリング課題で再現することに成功しました
意思決定障害に関わる脳の部位を神経活動の指標(c-Fosタンパク質の発現)を手がかりに探索して、淡蒼球外節と呼ばれる領域を特定しました
淡蒼球外節に存在する神経の活動を人工的に抑制することでパーキンソン病治療薬による意思決定障害が改善しました
淡蒼球外節を標的とした意思決定障害の新しい予防薬や治療薬の開発につながることが期待されます
<背 景>
パーキンソン病は黒質のドパミン神経細胞の脱落により手の震えや歩行障害などの運動症状を主とする神経変性疾患です。パーキンソン病は脳内のドパミンが不足し、運動を制御する大脳基底核※3という脳領域が正常に働かないことから生じると考えられています。そのため、治療にはL-DOPA※4やドパミンアゴニスト※5を用いたドパミン補充療法が適用されています。しかしながら、ドパミンアゴニストの服用中には、その副作用として病的賭博をはじめ、性欲亢進や買い物依存症といった衝動制御障害を呈し、社会生活に大きな問題をもたらします。病的賭博はハイリスク(罰)を顧みずハイリターン(報酬)を好み、持続的に繰り返されるギャンブルにより社会生活に支障をきたす問題行動として知られています。一方で、意思決定とは「複数の選択肢の中から最適なものを選ぶ行為」と定義されますが、病的賭博の背景には意思決定障害があると考えられています。
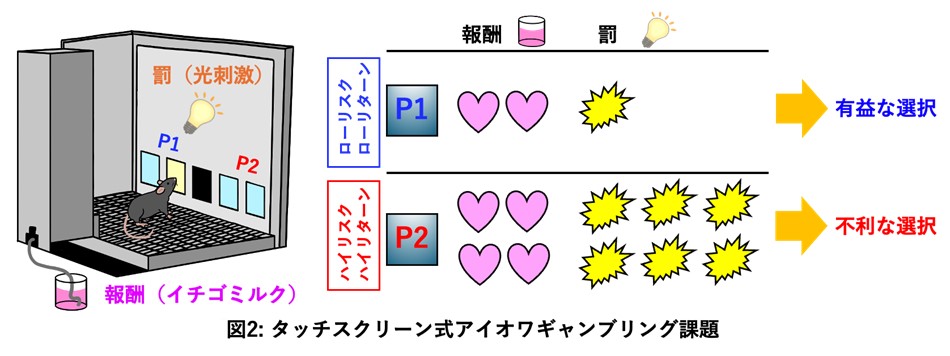
アイオワギャンブリング課題は、被験者が報酬額および損失額とその頻度が異なるデッキ(カードの山)から1枚ずつカードを選択し、最終的に報酬額を最大にすることが求められる課題で、ヒトの意思決定能力の評価に用いられています(図1)。「ローリスク・ローリターン」のデッキは長期的に得をし、「ハイリスク・ハイリターン」のデッキは長期的に損する設定になっています。治療中のパーキンソン病患者さんは、「ハイリスク・ハイリターン」の不利なデッキから選択する確率が高いことが報告されています(図1)。治療ガイドラインでは、病的賭博を発症した場合にはパーキンソン病治療薬の減量、変更あるいは中止が推奨されていますが、根本的な解決策は存在しません。したがって、パーキンソン病治療薬による意思決定障害の神経メカニズムの解明とそれに基づく新しい予防薬・治療薬の開発が急務となっています。
[画像1]https://digitalpr.jp/simg/2299/94561/600_230_2024090519122866d9840c1c81e.jpg
<研究手法・研究成果>
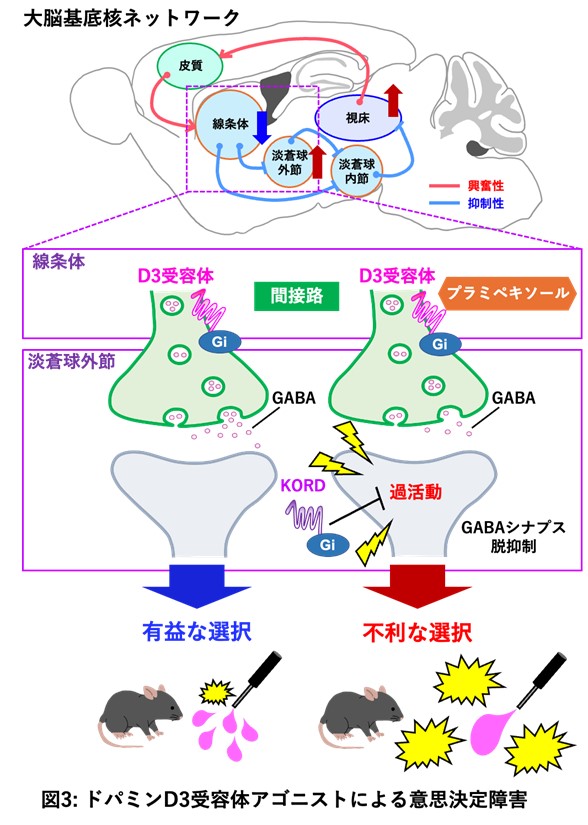
同研究グループは、パーキンソン病治療薬であるドパミンアゴニストのなかでも意思決定障害を高頻度に引き起こすことが知られているプラミペキソールに着目しました。プラミペキソールは主にドパミンD3受容体※6を刺激する作用を持つ治療薬です。パーキンソン病モデルマウスの意思決定障害をタッチスクリーン式アイオワギャンブリング課題で評価しました。この課題では、タッチスクリーン上で報酬(イチゴミルク)および罰(フラッシュ点滅光刺激)の量と頻度が異なるパネルの選択率を意思決定能力の指標としました(図2)。その結果、パーキンソン病モデルマウスにプラミペキソールを慢性投与すると、ハイリスク・ハイリターンに設定されたパネルの不利な選択率が増加しました。神経活動の指標であるc-Fos※7タンパク質の発現を解析した結果、プラミペキソールにより線条体の活動低下、淡蒼球外節と視床の活動亢進が認められ、大脳基底核を構成する神経ネットワークである間接路の異常が見つかりました。また、DREADD法※8により淡蒼球外節の活動を人工的に抑制した結果、プラミペキソールによる不利な選択率の増加は改善しました。以上のことから、アイオワギャンブリング課題においてプラミペキソールは意思決定障害を引き起こし、そのメカニズムとして淡蒼球外節の活動亢進が関与していることが明らかになりました(図3)。
[画像2]https://digitalpr.jp/simg/2299/94561/600_225_2024090519122866d9840c2e52d.jpg
<今後の展開>
本研究により、パーキンソン病治療薬による淡蒼球外節の活動亢進が意思決定障害に関わることを明らかにしました。今後、淡蒼球外節を標的とした意思決定障害の新しい予防薬・治療薬の開発が期待されます。また、意思決定障害は統合失調症、自閉スペクトラム症、認知症などでも共通して認められるため、本研究成果は精神・神経疾患の治療においても大きな進展につながることも期待されます。大脳基底核は大脳皮質や視床と協調し、運動、情動、認知機能を制御する3つの神経ネットワークを形成していますが、従来のドパミン補充療法はこれらすべてに影響を及ぼし、副作用を引き起こす可能性があります。一方、淡蒼球外節の神経は大脳基底核を超えた皮質領域などに幅広く投射されるので、意思決定障害に関わるさらなる神経ネットワークを特定することで副作用を防ぎ、より運動症状に特化した治療薬の開発が期待されます。
[画像3]https://digitalpr.jp/simg/2299/94561/400_561_2024090519122866d9840c2a1cc.jpg
<用語解説>
※1 アイオワギャンブリング課題
擬似紙幣を用いた賞金獲得ゲームに模した課題で意思決定能力を評価する神経心理検査の一つです。被験者は報酬額および損失額とその頻度が異なるデッキ(カードの山)から1枚ずつカードを選択し、最終的に報酬額を最大にすることが求められます。「ローリスク・ローリターン」のデッキは長期的に得をし、「ハイリスク・ハイリターン」のデッキは長期的に損する設定になっています。課題を通して社会生活に近い状況を作り出すことで、社会的な判断力や意思決定における障害を捉えることができます。
※2 淡蒼球外節
大脳基底核の一部を構成する脳部位の一つで、運動や認知機能の制御に関与しています。主に抑制性のGABA(γアミノ酪酸)作動性神経で構成されます。
※3 大脳基底核
大脳基底核は大脳皮質下の線条体、淡蒼球(内節/外節)、視床下核、黒質(網様部/緻密部)の4つの神経核で構成され、運動、情動、認知機能などの制御に関与しています。抑制性のGABA(γアミノ酪酸)作動性神経で構成された線条体を起点に、直接路と間接路の神経ネットワークを形成します。直接路は線条体の神経が直接、淡蒼球内節に投射する経路。間接路は線条体の神経が淡蒼球外節を経由して順に淡蒼球内節に至る経路。
※4 L-DOPA
ドパミンの前駆物質。服用することで脳内の不足しているドパミンを補うことができます。
※5 ドパミンアゴニスト
ドパミンに似た作用を持つ物質で、脳内でドパミンと同じようにドパミン受容体に結合し効果を発揮します。
※6 ドパミンD3受容体
ドパミンD3受容体は、脳内でドパミンと結合する受容体の一つ。ドパミン受容体には、D1、D2、D3、D4、D5の5種類あります。それぞれ異なる役割を持ち、様々な神経伝達に関与しています。
※7 c-Fos
最初期遺伝子の一つで、活性化した神経細胞で素早くc-Fosタンパク質の発現が誘導されます。神経活動の間接的なマーカーとしても利用されています。
※8 DREADD法
Designer receptors exclusively activated by designer drugs(DREADD)法は、人工受容体を特定の細胞に発現させて選択的な合成リガンド(受容体結合物質)を作用させることで特定の細胞の活性を制御できるため、神経ネットワーク研究において有用な手法です。本研究では、神経機能を抑制できるkappa-opioid DREADD (KORD) を用いています。
<文献情報>
●論文タイトル
Pramipexole Hyperactivates the External Globus Pallidus and Impairs Decision-Making in a Mouse Model of Parkinson’s Disease
●著者
窪田悠力1、周昕竹1、張心健1、渡辺宏久2、永井拓1
●所属
1藤田医科大学 精神・神経病態解明センター 神経行動薬理学研究部門
2藤田医科大学 医学部 脳神経内科学
●DOI
doi.org/10.3390/ijms25168849
本件に関するお問合わせ先
学校法人 藤田学園 広報部 TEL:0562-93-2868 e-mail:koho-pr@fujita-hu.ac.jp
プレスリリース詳細へ https://digitalpr.jp/r/94561
意思決定とは複数の選択肢から最適なものを選ぶ行為であり、ヒトの日常生活において重要な脳の働きです。食事、交通、買い物、金銭管理など様々な場面で意思決定を行いますが、時には暴飲暴食、浪費といった不合理な選択をしてしまうこともあります。持続的に不合理な選択をしてしまう状態を意思決定障害といいます。パーキンソン病治療薬を服用している患者さんでは、副作用として意思決定障害が高い頻度で認められ、治療を進めるうえで大きな問題となっています。しかしながら、パーキンソン病治療薬による意思決定障害の詳細なメカニズムは十分にわかっていませんでした。
藤田医科大学 精神・神経病態解明センター 神経行動薬理学研究部門の永井拓教授、窪田悠力助教と医学部 脳神経内科学の渡辺宏久教授らの研究グループは、ヒトにおいて意思決定能力の評価に用いられているアイオワギャンブリング課題※1をマウスの行動実験に応用し、淡蒼球外節※2と呼ばれる脳領域の活動亢進がパーキンソン病治療薬による意思決定障害に関わることを明らかにしました。本研究成果により、淡蒼球外節を標的とした意思決定障害の新しい予防薬や治療薬の開発につながることが期待されます。
本研究成果は、国際学術誌「International Journal of Molecular Sciences」(2024年8月14日)に掲載されました。
論文URL : https://www.mdpi.com/1422-0067/25/16/8849
<研究成果のポイント>
パーキンソン病モデルマウスを用いた実験で、パーキンソン病治療薬による意思決定障害をタッチスクリーン式アイオワギャンブリング課題で再現することに成功しました
意思決定障害に関わる脳の部位を神経活動の指標(c-Fosタンパク質の発現)を手がかりに探索して、淡蒼球外節と呼ばれる領域を特定しました
淡蒼球外節に存在する神経の活動を人工的に抑制することでパーキンソン病治療薬による意思決定障害が改善しました
淡蒼球外節を標的とした意思決定障害の新しい予防薬や治療薬の開発につながることが期待されます
<背 景>
パーキンソン病は黒質のドパミン神経細胞の脱落により手の震えや歩行障害などの運動症状を主とする神経変性疾患です。パーキンソン病は脳内のドパミンが不足し、運動を制御する大脳基底核※3という脳領域が正常に働かないことから生じると考えられています。そのため、治療にはL-DOPA※4やドパミンアゴニスト※5を用いたドパミン補充療法が適用されています。しかしながら、ドパミンアゴニストの服用中には、その副作用として病的賭博をはじめ、性欲亢進や買い物依存症といった衝動制御障害を呈し、社会生活に大きな問題をもたらします。病的賭博はハイリスク(罰)を顧みずハイリターン(報酬)を好み、持続的に繰り返されるギャンブルにより社会生活に支障をきたす問題行動として知られています。一方で、意思決定とは「複数の選択肢の中から最適なものを選ぶ行為」と定義されますが、病的賭博の背景には意思決定障害があると考えられています。
アイオワギャンブリング課題は、被験者が報酬額および損失額とその頻度が異なるデッキ(カードの山)から1枚ずつカードを選択し、最終的に報酬額を最大にすることが求められる課題で、ヒトの意思決定能力の評価に用いられています(図1)。「ローリスク・ローリターン」のデッキは長期的に得をし、「ハイリスク・ハイリターン」のデッキは長期的に損する設定になっています。治療中のパーキンソン病患者さんは、「ハイリスク・ハイリターン」の不利なデッキから選択する確率が高いことが報告されています(図1)。治療ガイドラインでは、病的賭博を発症した場合にはパーキンソン病治療薬の減量、変更あるいは中止が推奨されていますが、根本的な解決策は存在しません。したがって、パーキンソン病治療薬による意思決定障害の神経メカニズムの解明とそれに基づく新しい予防薬・治療薬の開発が急務となっています。
[画像1]https://digitalpr.jp/simg/2299/94561/600_230_2024090519122866d9840c1c81e.jpg
<研究手法・研究成果>
同研究グループは、パーキンソン病治療薬であるドパミンアゴニストのなかでも意思決定障害を高頻度に引き起こすことが知られているプラミペキソールに着目しました。プラミペキソールは主にドパミンD3受容体※6を刺激する作用を持つ治療薬です。パーキンソン病モデルマウスの意思決定障害をタッチスクリーン式アイオワギャンブリング課題で評価しました。この課題では、タッチスクリーン上で報酬(イチゴミルク)および罰(フラッシュ点滅光刺激)の量と頻度が異なるパネルの選択率を意思決定能力の指標としました(図2)。その結果、パーキンソン病モデルマウスにプラミペキソールを慢性投与すると、ハイリスク・ハイリターンに設定されたパネルの不利な選択率が増加しました。神経活動の指標であるc-Fos※7タンパク質の発現を解析した結果、プラミペキソールにより線条体の活動低下、淡蒼球外節と視床の活動亢進が認められ、大脳基底核を構成する神経ネットワークである間接路の異常が見つかりました。また、DREADD法※8により淡蒼球外節の活動を人工的に抑制した結果、プラミペキソールによる不利な選択率の増加は改善しました。以上のことから、アイオワギャンブリング課題においてプラミペキソールは意思決定障害を引き起こし、そのメカニズムとして淡蒼球外節の活動亢進が関与していることが明らかになりました(図3)。
[画像2]https://digitalpr.jp/simg/2299/94561/600_225_2024090519122866d9840c2e52d.jpg
<今後の展開>
本研究により、パーキンソン病治療薬による淡蒼球外節の活動亢進が意思決定障害に関わることを明らかにしました。今後、淡蒼球外節を標的とした意思決定障害の新しい予防薬・治療薬の開発が期待されます。また、意思決定障害は統合失調症、自閉スペクトラム症、認知症などでも共通して認められるため、本研究成果は精神・神経疾患の治療においても大きな進展につながることも期待されます。大脳基底核は大脳皮質や視床と協調し、運動、情動、認知機能を制御する3つの神経ネットワークを形成していますが、従来のドパミン補充療法はこれらすべてに影響を及ぼし、副作用を引き起こす可能性があります。一方、淡蒼球外節の神経は大脳基底核を超えた皮質領域などに幅広く投射されるので、意思決定障害に関わるさらなる神経ネットワークを特定することで副作用を防ぎ、より運動症状に特化した治療薬の開発が期待されます。
[画像3]https://digitalpr.jp/simg/2299/94561/400_561_2024090519122866d9840c2a1cc.jpg
<用語解説>
※1 アイオワギャンブリング課題
擬似紙幣を用いた賞金獲得ゲームに模した課題で意思決定能力を評価する神経心理検査の一つです。被験者は報酬額および損失額とその頻度が異なるデッキ(カードの山)から1枚ずつカードを選択し、最終的に報酬額を最大にすることが求められます。「ローリスク・ローリターン」のデッキは長期的に得をし、「ハイリスク・ハイリターン」のデッキは長期的に損する設定になっています。課題を通して社会生活に近い状況を作り出すことで、社会的な判断力や意思決定における障害を捉えることができます。
※2 淡蒼球外節
大脳基底核の一部を構成する脳部位の一つで、運動や認知機能の制御に関与しています。主に抑制性のGABA(γアミノ酪酸)作動性神経で構成されます。
※3 大脳基底核
大脳基底核は大脳皮質下の線条体、淡蒼球(内節/外節)、視床下核、黒質(網様部/緻密部)の4つの神経核で構成され、運動、情動、認知機能などの制御に関与しています。抑制性のGABA(γアミノ酪酸)作動性神経で構成された線条体を起点に、直接路と間接路の神経ネットワークを形成します。直接路は線条体の神経が直接、淡蒼球内節に投射する経路。間接路は線条体の神経が淡蒼球外節を経由して順に淡蒼球内節に至る経路。
※4 L-DOPA
ドパミンの前駆物質。服用することで脳内の不足しているドパミンを補うことができます。
※5 ドパミンアゴニスト
ドパミンに似た作用を持つ物質で、脳内でドパミンと同じようにドパミン受容体に結合し効果を発揮します。
※6 ドパミンD3受容体
ドパミンD3受容体は、脳内でドパミンと結合する受容体の一つ。ドパミン受容体には、D1、D2、D3、D4、D5の5種類あります。それぞれ異なる役割を持ち、様々な神経伝達に関与しています。
※7 c-Fos
最初期遺伝子の一つで、活性化した神経細胞で素早くc-Fosタンパク質の発現が誘導されます。神経活動の間接的なマーカーとしても利用されています。
※8 DREADD法
Designer receptors exclusively activated by designer drugs(DREADD)法は、人工受容体を特定の細胞に発現させて選択的な合成リガンド(受容体結合物質)を作用させることで特定の細胞の活性を制御できるため、神経ネットワーク研究において有用な手法です。本研究では、神経機能を抑制できるkappa-opioid DREADD (KORD) を用いています。
<文献情報>
●論文タイトル
Pramipexole Hyperactivates the External Globus Pallidus and Impairs Decision-Making in a Mouse Model of Parkinson’s Disease
●著者
窪田悠力1、周昕竹1、張心健1、渡辺宏久2、永井拓1
●所属
1藤田医科大学 精神・神経病態解明センター 神経行動薬理学研究部門
2藤田医科大学 医学部 脳神経内科学
●DOI
doi.org/10.3390/ijms25168849
本件に関するお問合わせ先
学校法人 藤田学園 広報部 TEL:0562-93-2868 e-mail:koho-pr@fujita-hu.ac.jp
プレスリリース詳細へ https://digitalpr.jp/r/94561