東京医科大学免疫学分野の横須賀忠主任教授ら研究チーム「免疫チェックポイント分子LAG-3による新たな免疫抑制メカニズムを発見」~ チェックポイント阻害剤抗LAG-3抗体によるがん免疫療法の理解に期待 ~
東京医科大学(学長:林 由起子/東京都新宿区)免疫学分野 横須賀 忠主任教授、若松英講師を中心とする研究チームは、免疫チェックポイント分子LAG-3の超解像分子イメージングを行い、LAG-3を発現するTリンパ球(T細胞)が、抗原提示細胞からMHCクラスII分子をもぎ取り(トランスエンドサイトーシス*)、抗原提示能力を低下させることを発見しました。この研究は日本学術振興会科学研究費補助金の支援のもとで行われたもので、その研究成果は国際科学誌 Cell Reports(IF=7.5)のオンライン版に8月26日(米国東部時間)付けで掲載されました。この成果によって、今後第3の免疫チェックポイント阻害剤として期待がかかる抗LAG-3抗体の免疫賦活化機構と抗腫瘍効果の理解に繋がることが期待されます。
【本研究のポイント】
・免疫チェックポイント分子LAG-3と、その相手方であるMHCクラスIIとが結合した分子の集合体を、世界で初めて可視化しました。
・T細胞が、LAG-3を介した『トランスエンドサイトーシス』というひきちぎりの機序により、抗原提示細胞からMHCクラスII分子を奪い取る、全く新しい免疫調節機構を発見しました。
・LAG-3によってMHCクラスIIが奪い取られた抗原提示細胞は、T細胞の活性化ができなくなるだけでなく、病原性CD4陽性T細胞による大腸炎の進行を抑えられる可能性も示されました。
【研究の背景】
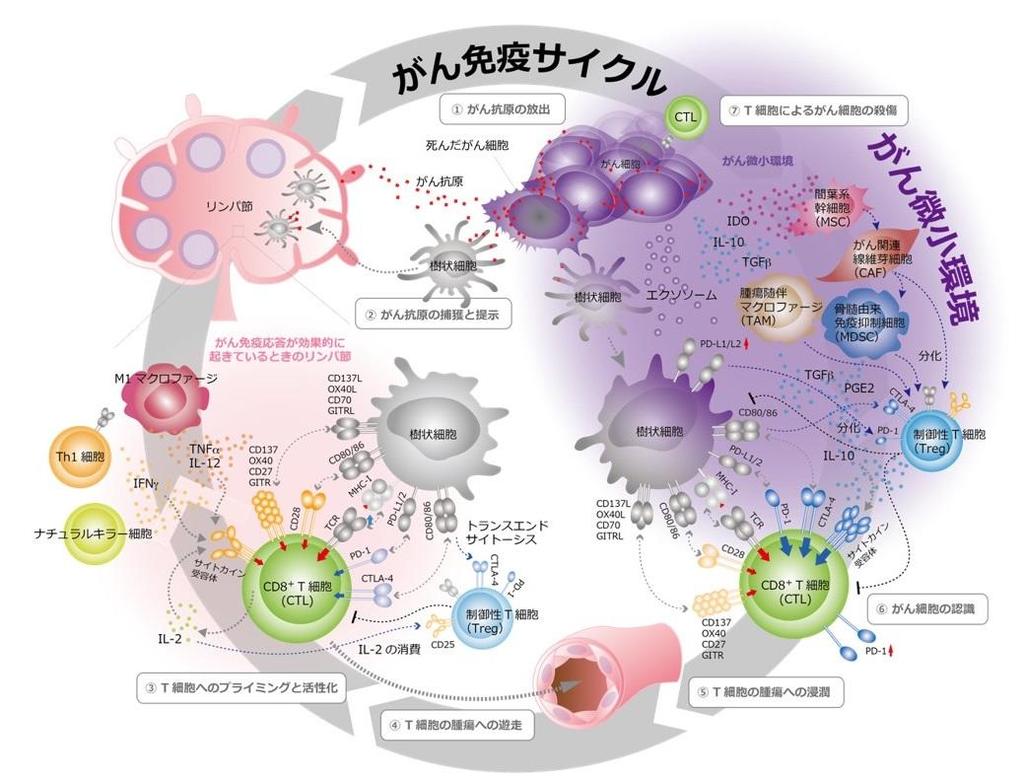
私達の体内では1日に3000個のがん細胞が生まれていますが、発がんには至りません。「免疫監視」と呼ばれるチェック機構が働き、免疫細胞が小さながんの芽を摘んでいるからです。がんに近い所属リンパ節では、がんの抗原が免疫細胞、特にT細胞へと提示され、活性化したT細胞は体内を循環し、がん細胞に遭遇するとこれを殺します。この好循環は、「がん免疫サイクル」と呼ばれています(図1)。しかし、ひとたび体力が衰えたり、がんが少し大きくなったりすると、がんは周囲を自らにとって住みやすい環境に作り変える、いわゆる「がん微小環境」を構築します。このようにがん免疫サイクルが破綻することで、がん細胞は急速に成長し発がんに至ります。
2018年にノーベル医学・生理学賞を受賞した免疫チェックポイント分子阻害(ICB)療法は、これまで治療の選択肢がなかった末期がん患者に対する奏効率から、2014年に日本国内で認可されると瞬く間にがんの標準治療になりました。しかしながら、現在、患者に投与されているPD-1、CTLA-4に対する抗体が全ての患者に対して有用であるというわけではありません。そのため、より有効性を得るため、ICB同士および他のがん治療との併用や、PD-1やCTLA-4に次ぐ、第3のICBの開発が進められています。LAG-3はPD-1やCTLA-4と同様に腫瘍に浸潤したT細胞(TIL)に高発現し、TILの疲弊化状態を誘導することと考えられています。そのため、他の免疫チェックポイント分子と同様にICBの標的として研究が進められ、2022年に米国食品医薬品局によって切除不能または転移のある悪性黒色腫に対する治療として抗PD-1抗体と抗LAG-3抗体の投与が承認されました。今後は日本でも抗LAG-3抗体が難治性のがん患者へ使用できるようになることが期待されています。しかしながら、PD-1やCTLA-4と異なり、LAG-3の免疫抑制機構は十分には理解されておらず、抗LAG-3抗体を投与する患者の選定や、複合免疫療法などの可能性を考慮する際の科学的な根拠が未だ構築されていません。そのため、LAG-3を介した免疫抑制機構の解明が必要とされています。
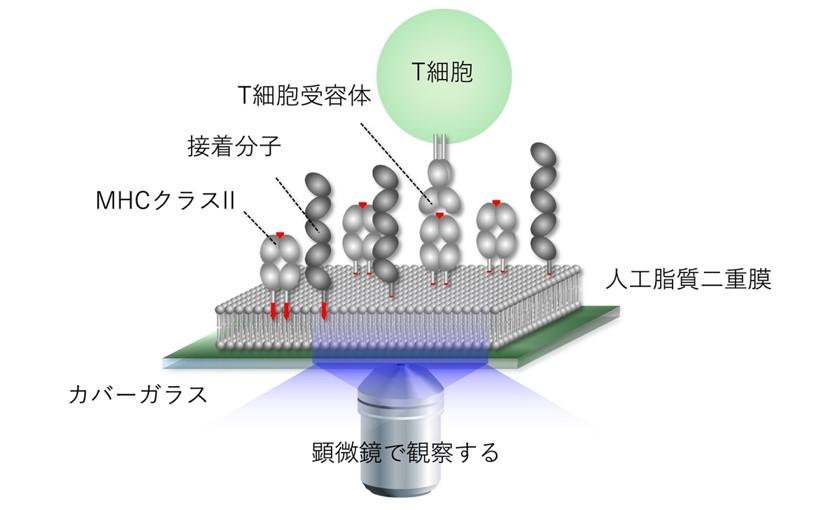
本研究室はこれまで、抗原提示細胞やがん細胞の細胞膜を模倣した人工平面脂質膜(SLB)と超解像顕微鏡とを用いることで、1分子レベルの解析も可能な独創的かつ先端的な分子イメージングシステムを構築してきました(Yokosuka et al,, Nat Immunol (2005))(図2)。
このシステムを用いて、マウスPD-1とPD-L1とが結合してできるPD-1の集合体「PD-1マイクロクラスター」がT細胞受容体(TCR)シグナルを抑えT細胞を疲弊状態に陥らせている現象を解明し、高い評価を得ています(Yokosuka et al., J Exp Med (2012)、Takehara et al., Commun Biol (2021)、Nishi et al., Nat Commun (2023))。本研究では、この分子イメージングシステムをLAG-3観察用にバージョンアップし、LAG-3を介したT細胞抑制機構の解明を目指しました。
【本研究で得られた結果・知見】
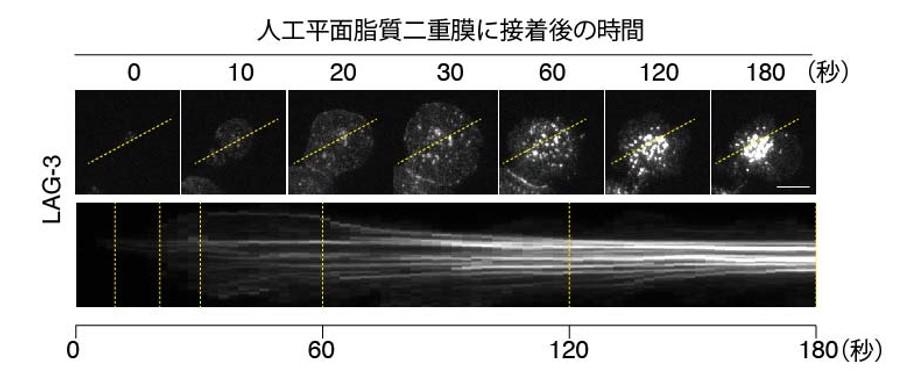
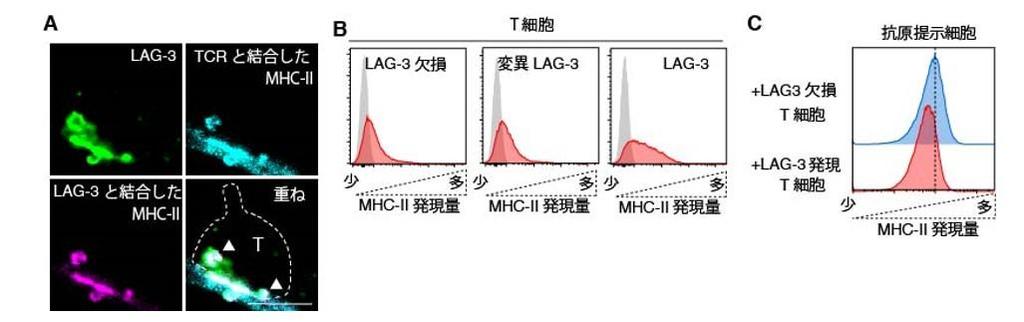
今回、T細胞上のLAG-3の動きを解析するため、LAG-3の1細胞分子イメージングの新たな実験系を確立しました。まず、LAG-3のリガンドであるMHCクラスII(MHC-II)を組み入れた「人工がん細胞脂質二重膜」を作成し、その上にLAG-3を発現しているT細胞をのせ、LAG-3の挙動を観察しました。T細胞は数分をかけて脂質二重膜に接着し、MHC-IIとの結合を機にLAG-3分子が数十個集まったクラスターが形成され、その後、LAG-3クラスターは真ん中に集まっていくのが観察されました(図3)。
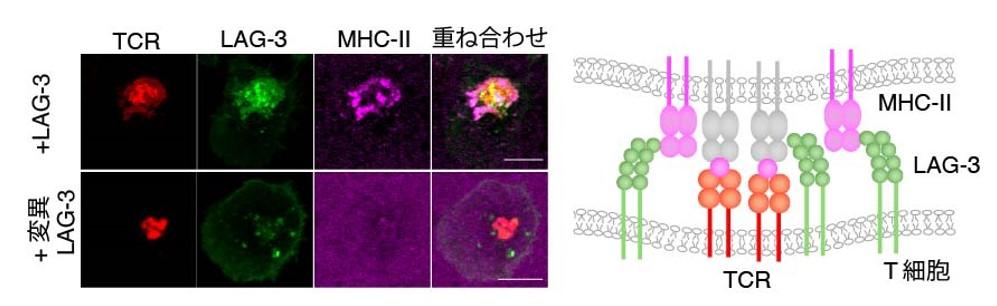
LAG-3はMHC-IIとの結合を機に分子の集合体を形成しますが、MHC-IIと結合できないLAG-3(変異LAG-3)は分子の集合体を形成することができませんでした(図4、緑)。また、LAG-3の凝集はTCRの凝集と同じ位置に形成し、リガンドであるMHC-IIもLAG-3と結合することでT細胞の真ん中に集まってきました(図4上段、マゼンタ)。
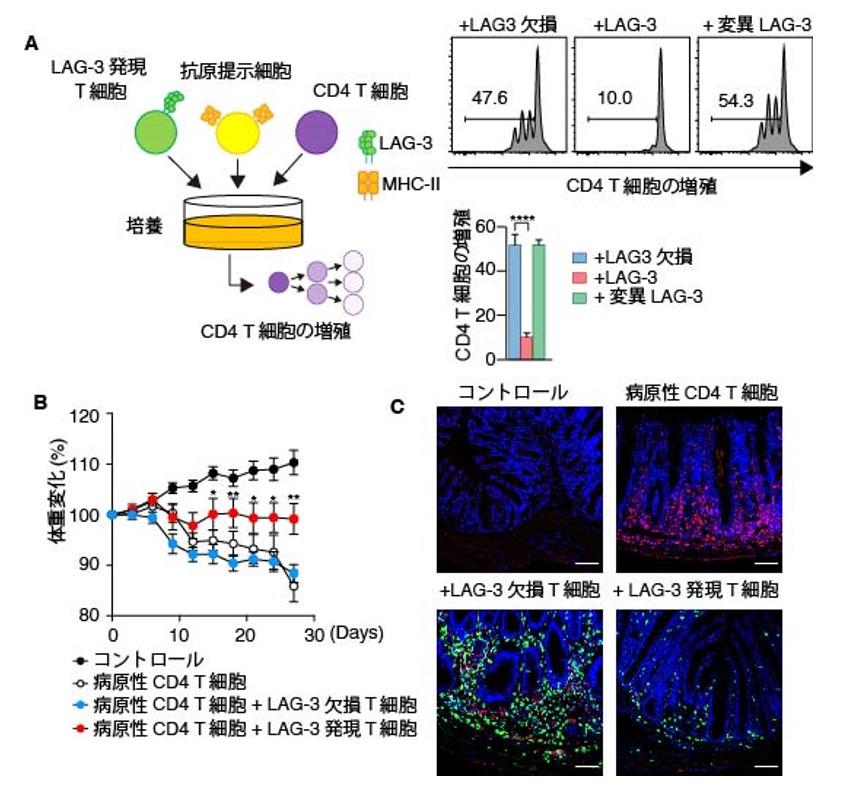
TCR集合体が集まる中心部超分子クラスター(cSMAC)は様々なシグナルを誘導するだけでなく、TCRをT細胞の中に取り込みシグナルを終焉させる構造であることが知られています。そのため、LAG-3によってcSMACに集められたMHC-IIがT細胞に取り込まれるかを観察しました。その結果、予想した通り、TCRと結合したMHC-II、およびLAG-3と結合したMHC-IIはLAG-3に囲まれるようにT細胞の中で検出されました(図5A)。また、フローサイトメトリーを用いて定量的に解析した結果、LAG-3欠損T細胞、および変異LAG-3を発現したT細胞と比較して、LAG-3を発現したT細胞はMHC-IIを取り込んでいました(図5B)。さらに、LAG-3発現T細胞と抗原提示細胞を一緒に培養することで、抗原提示細胞上のMHC-IIの発現が低下していました(図5C)。このような他の細胞の表面に発現する分子を取り込む現象は"トランスエンドサイトーシス"と呼ばれており、LAG-3発現T細胞はトランスエンドサイトーシスによって抗原提示細胞上のMHC-IIを減少させることがわかりました。
図5でLAG-3発現T細胞が抗原提示細胞上のMHC-IIを減少させることがわかりました。MHC-IIはCD4 T細胞の活性化に必須の分子であることから、LAG-3発現T細胞によってMHC-IIが減少した抗原提示細胞がCD4 T細胞を活性化する能力を失っているかを評価しました。その結果、図5でMHC-IIの取り込みが起こらなかったLAG-3欠損、および変異LAG-3を発現したT細胞との培養ではCD4 T細胞は分裂しましたが、LAG-3発現T細胞との培養では、CD4 T細胞が分裂できなくなることが認められました(図6A)。個体の中でも同様にLAG-3発現T細胞がCD4 T細胞の活性化を抑制するかを評価するために、CD4 T細胞が病原性T細胞として働くことで発症する腸炎モデルで検証しました。その結果、LAG-3欠損T細胞を病原性T細胞と共にマウスに移入しても、体重減少に違いは認められませんでしたが、LAG-3発現T細胞と共に移入することで、体重減少が抑えられることがわかりました(図6B)。また、病変部位である大腸を組織学的に解析したところ、病原性CD4 T細胞のみ、もしくは病原性CD4 T細胞とLAG-3欠損T細胞を移入したマウスと比較して、LAG-3発現T細胞を共移入したマウスでは大腸に病原性CD4 T細胞(赤色)が少ないことがわかりました(図6C)。
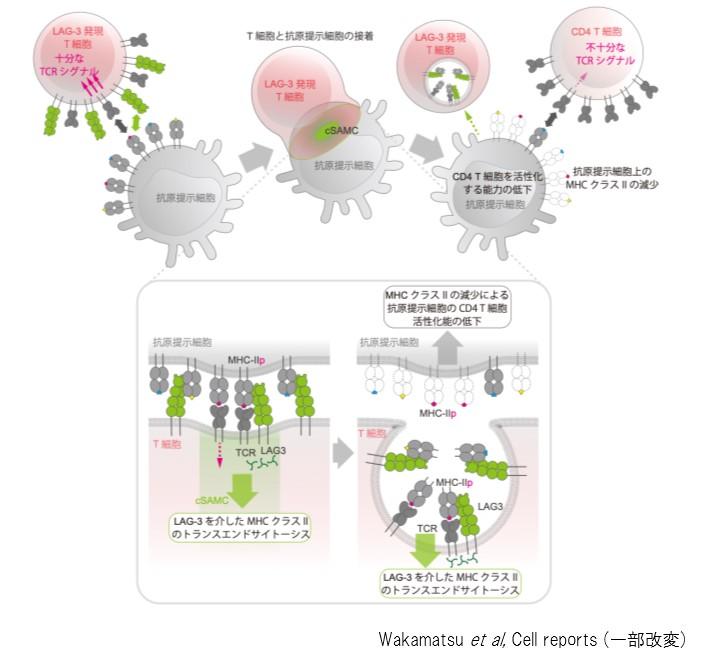
本研究から、T細胞上のLAG-3はリガンドであるMHC-IIと結合することで、LAG-3集合体を形成し、MHC-IIをcSMACに集めることがわかりました。また、cSMACに集められたMHC-IIはTCRのT細胞への取り込みとともにT細胞に取り込まれ、抗原提示細胞上のMHC-IIの数を減少させます。それによって、抗原提示細胞はCD4 T細胞の活性化能が低下し、CD4 T細胞が活性化するための刺激を与えられなくなります(図7)。これまで、LAG-3を介した免疫抑制作用はLAG-3を発現しているT細胞に負のシグナルを誘導すると考えられていました。しかし、本研究結果から、LAG-3発現T細胞による抗原提示細胞上のMHC-IIを減少させるという間接的にCD4 T細胞の活性化を抑制機構が存在することが明らかとなりました。
【今後の研究展開および波及効果】
抗LAG-3抗体が一昨年に難治性のがん患者への治療として米国で承認され、今後、日本でも現在使用されている免疫チェックポイント分子阻害抗体(ICB)との併用療法が現実的になってきました。しかし、LAG-3自身の免疫抑制作用が理解されない状況は抗LAG-3抗体を投与する患者の選定や、複合免疫療法などの可能性を考慮する際の科学的な根拠が欠けているだけでなく、抗体投与によって発生する副作用の予測も十分には行えないことが予想されます。これまで、がん免疫において抗LAG-3抗体はCD8 T細胞を活性化することでがんの縮小に繋がると考えられてきましたが、本研究結果から、CD8 T細胞だけでなくCD4 T細胞の活性化も誘導できる可能性が示されました。これらの結果は、抗PD-1抗体およびそれ以外のICBや化学療法を併用する際の選定の一助となり、またCD4 T細胞による炎症が副作用として発生する可能性を事前に考慮する根拠となることが予想されます。それにより、今後、抗LAG-3抗体をがん患者に使用する際に、より効率的かつ安全性の高い投与法の開発に繋がることが期待されます。
【語句説明】
*トランスエンドサイトーシス
一般に、ある細胞が受容体などを介して、相手方の細胞の一部を含めてかじり取る機構を示す。貪食様式の1つであり、トロゴサイトーシスとも呼ばれる。赤痢アメーバが腸管上皮をかじり取り、病状の悪化に繋がる現象がよく知られており、単細胞生物から哺乳動物まで進化的に広く保存されている。免疫細胞でも頻繁に使われ、奪い取った分子を自分の細胞表面に発現し新たな機能を獲得したり、制御性T細胞が免疫チェックポイント分子CTLA-4を介して抗原提示細胞からリガンドCD80/CD86を奪い取り、免疫機能が低下したりする例が知られている。
【掲載誌名・DOI】
掲載誌名:Cell reports
DOI:10.1016/j.celrep.2024.114655
【論文タイトル】
Indirect suppression of CD4 T-cell activation through LAG-3-mediated trans-endocytosis of MHC class II
【著者】
Ei Wakamatsu*, Hiroaki Machiyama, Hiroko Toyota, Arata Takeuchi, Ryuji Hashimoto, Haruo Kozono, Tadashi Yokosuka*
(*責任著者)
【主な競争的研究資金】
本研究は、文部科学省基盤研究(JP25113725, JP15H01194, JP16H06501, JP17H03600, JP19K07718, JP19K22545, JP20H03536, JP23H02775)、さきがけ慢性炎症(U1114011)、新学術領域「ネオ・セルフ」(JP16H06501)、学術変革A「自己指向性免疫」(JP23H04790)、「私立大学戦略的研究基盤形成支援事業」(S1511011)、内藤記念科学振興財団、武田科学振興財団の支援を受けています。
▼本件に関する問い合わせ先
企画部 広報・社会連携推進室
住所:〒160-8402 東京都新宿区新宿6-1-1
TEL:03-3351-6141
メール:d-koho@tokyo-med.ac.jp
【リリース発信元】 大学プレスセンター https://www.u-presscenter.jp/
プレスリリース詳細へ https://digitalpr.jp/r/93956