新しいメチル化DNA結合タンパク質を発見
~DNAメチル化継承の新しい概念を提唱~
横浜市立大学大学院生命医科学研究科 構造生物学研究室(エピジェネティクス構造生命科学)有田恭平教授、敷町怜愛さん(2023年度修士課程修了)、蛭田萌理さん(修士課程2年)、菊地杏美香さん(博士課程1年)、東京大学医科学研究所 癌防御シグナル分野 西山敦哉准教授、中西真教授、ロックフェラー大学 Isabel E. Wassing博士研究員、船引宏則教授らを中心とした国際共同研究グループは、免疫不全・セントロメア不安定症候群(ICF症候群*1)の原因遺伝子であるCDCA7とHELLSが、ヘテロクロマチン領域のDNAメチル化*2の維持に働く分子機構を明らかにしました。本成果は、CDCA7-HELLSリモデリング複合体がDNA維持メチル化に果たす役割についての新たな洞察を提供するとともに、ICF症候群の病態メカニズムの解明に貢献する可能性があります。
本研究成果は、「Science Advances」に掲載されました(日本時間2024年8月24日午前3時)。
研究成果のポイント
ICF症候群の原因遺伝子CDCA7が、新規の片鎖メチル化DNA結合タンパク質であることを同定。
クライオ電子顕微鏡単粒子解析によって、CDCA7によるヌクレオソーム中の片鎖メチル化DNAの認識機構を解明。
ヘテロクロマチン領域特有のDNA維持メチル化の分子機構の新しい概念を発見。
CDCA7変異で発症するICF症候群のDNA低メチル化の原因を解明。
[画像1]https://digitalpr.jp/simg/1706/93556/550_250_2024082016415266c448c01b009.jpg
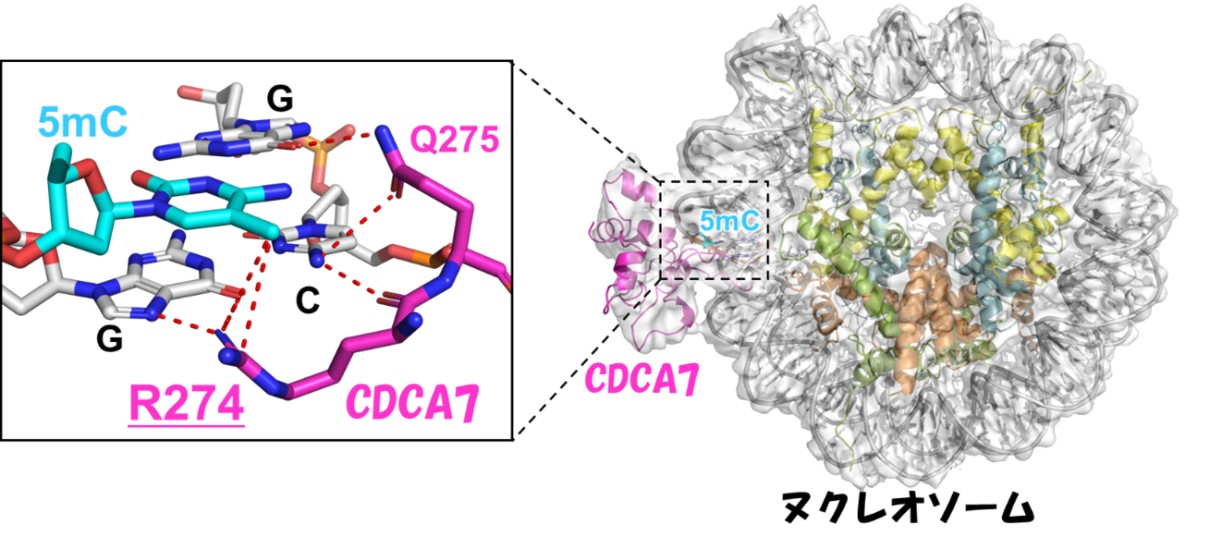
図1 片鎖メチル化DNAを含むヌクレオソームとCDCD7の複合体構造
研究背景
哺乳類のCG配列中のシトシンに起こるDNAメチル化は遺伝子発現のオン・オフを決め、細胞の形質を決める細胞記憶として働きます。従って、細胞増殖に伴うDNAメチル化パターンの正確な継承は、細胞の形質を維持するために不可欠です。この仕組みの破綻は異常な発生・分化に加えて、細胞のがん化や染色体不安定化を引き起こすことで、様々な疾患の原因になると考えられています。したがって、DNAメチル化維持の分子機構の全貌を明らかにすることは、科学的にも社会的にも重要な課題です。
DNAのメチル化異常が関与する疾患の一つとして、ICF(Immunodeficiency, Centromeric instability, Facial anomaly)症候群が知られています。ICF症候群はクロマチンリモデリング因子*3 HELLSとその活性化因子CDCA7の変異を原因とし、ヘテロクロマチンの低メチル化を特徴としています。CDCA7が持つジンクフィンガードメイン(ZnFドメイン) は真核生物に広く保存されていますが、DNAメチル化やDNAメチルトランスフェラーゼが欠如している種では見られないことから、DNAメチル化との関連が示唆されていました。しかし、CDCA7がDNAメチル化にどのように関与し、ICF症候群で見られるCDCA7変異がなぜDNA低メチル化を引き起こすのかはよくわかっていませんでした。
研究内容
研究グループは、アフリカツメガエルの卵抽出液を用いた実験から、CDCA7のZnFドメインが片鎖メチル化DNAに特異的な結合能を持つことを明らかにしました。これまでに、DNAメチル化維持に関与するUHRF1*4のSRAドメインが唯一の片鎖メチル化DNA結合タンパク質として報告されていましたが、CDCA7は第2の片鎖メチル化DNA結合タンパク質であることが明らかになりました。興味深いことに、UHRF1はヌクレオソーム中の片鎖メチル化DNAに結合できませんが、CDCA7はヌクレオソーム中の片鎖メチル化DNAに強固に結合できることがわかり、UHRF1とは異なる結合特性を持つことがわかりました。この認識機構を明らかにするために、片鎖メチル化サイトを持つヌクレオソームとCDCA7の複合体構造をクライオ電子顕微鏡単粒子解析*5で決定しました(図1)。その結果、CDCA7がヌクレオソーム中の片鎖メチル化サイトに結合している様子を捉えることに成功しました。興味深いことに、ICF症候群に関与するCDCA7のアルギニン274は、直接的に片鎖メチル化サイト中の5メチルシトシンの認識に関与し、さらにアルギニン304はDNAのリン酸骨格の認識に関与していました(図1)。実際にアルギニン274をヒスチジンに置換すると片鎖メチル化DNA結合能が消失したことから、ICF症候群で見られるDNA低メチル化はCDCA7の片鎖メチル化DNA結合能の喪失によることが明らかになりました。
なぜCDCA7の機能喪失がDNA低メチル化につながるのでしょうか? アフリカツメガエルの卵抽出液を用いた実験から、CDCA7はアミノ末端領域のα-ヘリックス*6を使ってHELLSと直接的に結合することがわかりました。さらにCDCA7を欠損させた卵抽出液では、クロマチンへのHELLSの集積が阻害され、その結果ヒストンH3のユビキチン化の効率が減少し、DNMT1のクロマチン局在量も低減することがわかりました。このことから、CDCA7がクロマチン中の片鎖メチル化DNAを認識してHELLSを呼び込み、DNAメチル化を触媒するDNMT1の片鎖メチル化DNAへの局在に重要であることがわかりました。つまり、片鎖メチル化DNAの結合能を失ったCDCA7は、下流で働く維持メチル化因子の正しい局在に異常をきたすので、DNA低メチル化が起こることがわかりました。
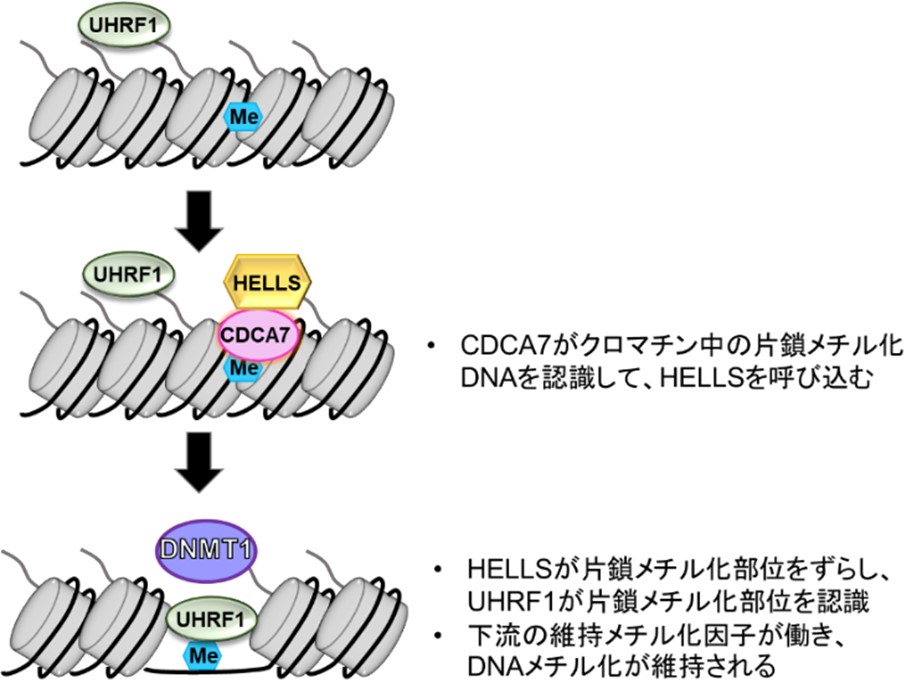
本研究により、ICF症候群の原因遺伝子であるCDCA7が片鎖メチル化DNAを認識することを明らかにし、DNAメチル化維持の制御の新しい分子メカニズムを提唱しました。これまでDNA維持メチルでは、DNAメチル化酵素DNMT1とその呼び込みタンパク質UHRF1が重要な働きをすることが知られていました。UHRF1は複製時に一時的に生じる片鎖メチル化DNAに特異的に結合し、ヒストンH3をユビキチン化します。このユビキチン化H3がDNMT1のDNAメチル化部位局在に不可欠な役割をします。これに加えて新たにヘテロクロマチン領域の維持メチル化では、次のことが起こることがわかりました(図2)。
1) CDCA7はヌクレオソーム中の片鎖メチル化DNAに結合してHELLSを呼び込む。
2) HELLSのクロマチンリモデリング活性によって片鎖メチル化サイトがヌクレオソームからずらされて、リンカーDNA上に露出する。
3) UHRF1がリンカーDNA上の片鎖メチル化サイトに結合しヒストンH3をユビキチン化して、DNMT1をクロマチンに呼び込む。
[画像2]https://digitalpr.jp/simg/1706/93556/550_417_2024082016415566c448c302451.jpg
図2:本研究で明らかにしたヘテロクロマチン領域のDNA維持メチル化の新しい分子機構
今後の展開
セントロメアやペリセントロメアで見られるヘテロクロマチンは染色体構造の安定化に寄与する他に、進化の過程で取り込まれたトランスポゾン(動く遺伝子)の抑制にも働きます。本研究で発見したCDCA7-HELLSの機能はこのような領域に特有のDNAメチル化維持の制御に重要であることが考えられます。クライオ電子顕微鏡単粒子解析によって、 ICF症候群の発症に関与するCDCA7のアミノ酸残基が片鎖メチル化DNAを認識することが分かり、ICF症候群で見られるCDCA7変異によってもたらされるDNA低メチル化の分子機構が明らかになりました。この知見は、ICF症候群の病態メカニズム解明や将来的な治療法開発に貢献する可能性があります。
研究費
本研究は、JSPS科研費 新学術領域「多様かつ堅牢な細胞形質を支える非ゲノム情報複製機構(19H05741, JP19H05740)」(JP19H03143, JP19H05285)をはじめ、横浜市立大学(学長裁量事業)戦略的研究推進事業などの助成を受けて行われました。
論文情報
タイトル: CDCA7 is an evolutionarily conserved hemimethylated DNA sensor in eukaryotes
著者: Isabel E. Wassing†, Atsuya Nishiyama*†, Reia Shikimachi, Qingyuan Jia, Amika Kikuchi, Moeri Hiruta, Keita Sugimura, Xin Hong, Yoshie Chiba, Junhui Peng, Christopher Jenness, Makoto Nakanishi, Li Zhao, Kyohei Arita*, Hironori Funabiki*
† Equal contribution, * Corresponding authors
掲載雑誌:Science Advances
DOI:https://doi.org/10.1126/sciadv.adp5753
[画像3]https://digitalpr.jp/simg/1706/93556/450_81_2024082016415766c448c59d3f1.jpg
用語説明
*1 ICF症候群:免疫不全、染色体の不安定性、軽度の顔貌異常を特徴とした先天性の免疫不全症候群に分類される常染色体劣性遺伝病。
*2 DNAメチル化:DNA中のシトシン塩基の5位の炭素にメチル基(CH3-)が付加される反応。ヒトでは主にCG配列中のシトシン塩基がメチル化される。DNAメチル化により、遺伝子の発現が抑制されると考えられている。生物の体(多細胞の形質)を形成するために必須であり、DNAメチル化異常はがん化の原因の一つである。
*3 クロマチンリモデリング因子:DNA がヒストンタンパク質に巻き付いた構造体をヌクレオソームと呼び、ヌクレオソームが集合してさらに高次の構造をとったものをクロマチンと呼ぶ。クロマチンリモデリング因子は、ヌクレオソームの配置替えをして、転写の状態を調節する因子である。
*4 UHRF1:DNAメチル化維持に必須の役割をするタンパク質。片鎖メチル化DNAへの結合や、9番目のリジンがメチル化されたヒストンH3への結合、ヒストンH3や複製因子PAF15のユビキチン化など様々な機能を発揮することで、DNAメチル化パターンの複製を誘導する。がん細胞では過剰発現しており、異常な細胞増殖に関与する。
*5 クライオ電子顕微鏡単粒子解析:タンパク質の立体構造を明らかにする手法の一つ。生体分子をマイナス180 ºC近い極低温状態の氷の中に包埋し、その状態で電子顕微鏡により観測する。観測した生体分子の粒子像を大量に撮影し、得られた数十万の粒子像から3次元に再構成することで立体構造を明らかにする手法のこと。
*6 α-ヘリックス:タンパク質中の局所的な構造体で、左巻きのらせん状の構造を形成している領域。
プレスリリース詳細へ https://digitalpr.jp/r/93556
横浜市立大学大学院生命医科学研究科 構造生物学研究室(エピジェネティクス構造生命科学)有田恭平教授、敷町怜愛さん(2023年度修士課程修了)、蛭田萌理さん(修士課程2年)、菊地杏美香さん(博士課程1年)、東京大学医科学研究所 癌防御シグナル分野 西山敦哉准教授、中西真教授、ロックフェラー大学 Isabel E. Wassing博士研究員、船引宏則教授らを中心とした国際共同研究グループは、免疫不全・セントロメア不安定症候群(ICF症候群*1)の原因遺伝子であるCDCA7とHELLSが、ヘテロクロマチン領域のDNAメチル化*2の維持に働く分子機構を明らかにしました。本成果は、CDCA7-HELLSリモデリング複合体がDNA維持メチル化に果たす役割についての新たな洞察を提供するとともに、ICF症候群の病態メカニズムの解明に貢献する可能性があります。
本研究成果は、「Science Advances」に掲載されました(日本時間2024年8月24日午前3時)。
研究成果のポイント
ICF症候群の原因遺伝子CDCA7が、新規の片鎖メチル化DNA結合タンパク質であることを同定。
クライオ電子顕微鏡単粒子解析によって、CDCA7によるヌクレオソーム中の片鎖メチル化DNAの認識機構を解明。
ヘテロクロマチン領域特有のDNA維持メチル化の分子機構の新しい概念を発見。
CDCA7変異で発症するICF症候群のDNA低メチル化の原因を解明。
[画像1]https://digitalpr.jp/simg/1706/93556/550_250_2024082016415266c448c01b009.jpg
図1 片鎖メチル化DNAを含むヌクレオソームとCDCD7の複合体構造
研究背景
哺乳類のCG配列中のシトシンに起こるDNAメチル化は遺伝子発現のオン・オフを決め、細胞の形質を決める細胞記憶として働きます。従って、細胞増殖に伴うDNAメチル化パターンの正確な継承は、細胞の形質を維持するために不可欠です。この仕組みの破綻は異常な発生・分化に加えて、細胞のがん化や染色体不安定化を引き起こすことで、様々な疾患の原因になると考えられています。したがって、DNAメチル化維持の分子機構の全貌を明らかにすることは、科学的にも社会的にも重要な課題です。
DNAのメチル化異常が関与する疾患の一つとして、ICF(Immunodeficiency, Centromeric instability, Facial anomaly)症候群が知られています。ICF症候群はクロマチンリモデリング因子*3 HELLSとその活性化因子CDCA7の変異を原因とし、ヘテロクロマチンの低メチル化を特徴としています。CDCA7が持つジンクフィンガードメイン(ZnFドメイン) は真核生物に広く保存されていますが、DNAメチル化やDNAメチルトランスフェラーゼが欠如している種では見られないことから、DNAメチル化との関連が示唆されていました。しかし、CDCA7がDNAメチル化にどのように関与し、ICF症候群で見られるCDCA7変異がなぜDNA低メチル化を引き起こすのかはよくわかっていませんでした。
研究内容
研究グループは、アフリカツメガエルの卵抽出液を用いた実験から、CDCA7のZnFドメインが片鎖メチル化DNAに特異的な結合能を持つことを明らかにしました。これまでに、DNAメチル化維持に関与するUHRF1*4のSRAドメインが唯一の片鎖メチル化DNA結合タンパク質として報告されていましたが、CDCA7は第2の片鎖メチル化DNA結合タンパク質であることが明らかになりました。興味深いことに、UHRF1はヌクレオソーム中の片鎖メチル化DNAに結合できませんが、CDCA7はヌクレオソーム中の片鎖メチル化DNAに強固に結合できることがわかり、UHRF1とは異なる結合特性を持つことがわかりました。この認識機構を明らかにするために、片鎖メチル化サイトを持つヌクレオソームとCDCA7の複合体構造をクライオ電子顕微鏡単粒子解析*5で決定しました(図1)。その結果、CDCA7がヌクレオソーム中の片鎖メチル化サイトに結合している様子を捉えることに成功しました。興味深いことに、ICF症候群に関与するCDCA7のアルギニン274は、直接的に片鎖メチル化サイト中の5メチルシトシンの認識に関与し、さらにアルギニン304はDNAのリン酸骨格の認識に関与していました(図1)。実際にアルギニン274をヒスチジンに置換すると片鎖メチル化DNA結合能が消失したことから、ICF症候群で見られるDNA低メチル化はCDCA7の片鎖メチル化DNA結合能の喪失によることが明らかになりました。
なぜCDCA7の機能喪失がDNA低メチル化につながるのでしょうか? アフリカツメガエルの卵抽出液を用いた実験から、CDCA7はアミノ末端領域のα-ヘリックス*6を使ってHELLSと直接的に結合することがわかりました。さらにCDCA7を欠損させた卵抽出液では、クロマチンへのHELLSの集積が阻害され、その結果ヒストンH3のユビキチン化の効率が減少し、DNMT1のクロマチン局在量も低減することがわかりました。このことから、CDCA7がクロマチン中の片鎖メチル化DNAを認識してHELLSを呼び込み、DNAメチル化を触媒するDNMT1の片鎖メチル化DNAへの局在に重要であることがわかりました。つまり、片鎖メチル化DNAの結合能を失ったCDCA7は、下流で働く維持メチル化因子の正しい局在に異常をきたすので、DNA低メチル化が起こることがわかりました。
本研究により、ICF症候群の原因遺伝子であるCDCA7が片鎖メチル化DNAを認識することを明らかにし、DNAメチル化維持の制御の新しい分子メカニズムを提唱しました。これまでDNA維持メチルでは、DNAメチル化酵素DNMT1とその呼び込みタンパク質UHRF1が重要な働きをすることが知られていました。UHRF1は複製時に一時的に生じる片鎖メチル化DNAに特異的に結合し、ヒストンH3をユビキチン化します。このユビキチン化H3がDNMT1のDNAメチル化部位局在に不可欠な役割をします。これに加えて新たにヘテロクロマチン領域の維持メチル化では、次のことが起こることがわかりました(図2)。
1) CDCA7はヌクレオソーム中の片鎖メチル化DNAに結合してHELLSを呼び込む。
2) HELLSのクロマチンリモデリング活性によって片鎖メチル化サイトがヌクレオソームからずらされて、リンカーDNA上に露出する。
3) UHRF1がリンカーDNA上の片鎖メチル化サイトに結合しヒストンH3をユビキチン化して、DNMT1をクロマチンに呼び込む。
[画像2]https://digitalpr.jp/simg/1706/93556/550_417_2024082016415566c448c302451.jpg
図2:本研究で明らかにしたヘテロクロマチン領域のDNA維持メチル化の新しい分子機構
今後の展開
セントロメアやペリセントロメアで見られるヘテロクロマチンは染色体構造の安定化に寄与する他に、進化の過程で取り込まれたトランスポゾン(動く遺伝子)の抑制にも働きます。本研究で発見したCDCA7-HELLSの機能はこのような領域に特有のDNAメチル化維持の制御に重要であることが考えられます。クライオ電子顕微鏡単粒子解析によって、 ICF症候群の発症に関与するCDCA7のアミノ酸残基が片鎖メチル化DNAを認識することが分かり、ICF症候群で見られるCDCA7変異によってもたらされるDNA低メチル化の分子機構が明らかになりました。この知見は、ICF症候群の病態メカニズム解明や将来的な治療法開発に貢献する可能性があります。
研究費
本研究は、JSPS科研費 新学術領域「多様かつ堅牢な細胞形質を支える非ゲノム情報複製機構(19H05741, JP19H05740)」(JP19H03143, JP19H05285)をはじめ、横浜市立大学(学長裁量事業)戦略的研究推進事業などの助成を受けて行われました。
論文情報
タイトル: CDCA7 is an evolutionarily conserved hemimethylated DNA sensor in eukaryotes
著者: Isabel E. Wassing†, Atsuya Nishiyama*†, Reia Shikimachi, Qingyuan Jia, Amika Kikuchi, Moeri Hiruta, Keita Sugimura, Xin Hong, Yoshie Chiba, Junhui Peng, Christopher Jenness, Makoto Nakanishi, Li Zhao, Kyohei Arita*, Hironori Funabiki*
† Equal contribution, * Corresponding authors
掲載雑誌:Science Advances
DOI:https://doi.org/10.1126/sciadv.adp5753
[画像3]https://digitalpr.jp/simg/1706/93556/450_81_2024082016415766c448c59d3f1.jpg
用語説明
*1 ICF症候群:免疫不全、染色体の不安定性、軽度の顔貌異常を特徴とした先天性の免疫不全症候群に分類される常染色体劣性遺伝病。
*2 DNAメチル化:DNA中のシトシン塩基の5位の炭素にメチル基(CH3-)が付加される反応。ヒトでは主にCG配列中のシトシン塩基がメチル化される。DNAメチル化により、遺伝子の発現が抑制されると考えられている。生物の体(多細胞の形質)を形成するために必須であり、DNAメチル化異常はがん化の原因の一つである。
*3 クロマチンリモデリング因子:DNA がヒストンタンパク質に巻き付いた構造体をヌクレオソームと呼び、ヌクレオソームが集合してさらに高次の構造をとったものをクロマチンと呼ぶ。クロマチンリモデリング因子は、ヌクレオソームの配置替えをして、転写の状態を調節する因子である。
*4 UHRF1:DNAメチル化維持に必須の役割をするタンパク質。片鎖メチル化DNAへの結合や、9番目のリジンがメチル化されたヒストンH3への結合、ヒストンH3や複製因子PAF15のユビキチン化など様々な機能を発揮することで、DNAメチル化パターンの複製を誘導する。がん細胞では過剰発現しており、異常な細胞増殖に関与する。
*5 クライオ電子顕微鏡単粒子解析:タンパク質の立体構造を明らかにする手法の一つ。生体分子をマイナス180 ºC近い極低温状態の氷の中に包埋し、その状態で電子顕微鏡により観測する。観測した生体分子の粒子像を大量に撮影し、得られた数十万の粒子像から3次元に再構成することで立体構造を明らかにする手法のこと。
*6 α-ヘリックス:タンパク質中の局所的な構造体で、左巻きのらせん状の構造を形成している領域。
プレスリリース詳細へ https://digitalpr.jp/r/93556