配信記事やプレスリリースは、配信・発表元による原稿をそのまま掲載しています。 お問い合わせは各情報配信・発表元に直接お願いします。
【横浜市立大学】アクアポリン3の新規チャネル閉鎖構造を発見
-クライオ電子顕微鏡でアクアポリン3の構造を解析し、 他の水チャネルには見られない、水の通路が塞がれた構造を解明-
研究成果のポイント
水チャネルの一つであるAQP3(アクアポリン3)の立体構造を初めて解明。
水の通路が細胞外側のループ領域によって塞がれた新規のチャネル構造を発見。他の水チャネルでは報告されていない独自の構造的特徴を明らかに。
本研究の成果により、アクアポリン3を標的とする創薬研究の加速が期待される。
研究概要
東京科学大学(Science Tokyo)総合研究院 高等研究府 細胞構造生理学研究室の藤吉好則特別栄誉教授、香西大輔プロジェクト助教らは、横浜市立大学 大学院生命医科学研究科の池口満徳教授、井上雅郎特任助教らと共同で、細胞内外の水輸送に関与する膜タンパク質として知られる水チャネル(用語1)の一種であるアクアポリン3(用語2)の立体構造解析(用語3)を行いました。その結果、アクアポリン3は、これまで構造解析が行われた多くの水チャネルでは見られなかった、細胞外側から水の通路がほぼ塞がれたチャネル構造を持つことを発見しました。
これまで、アクアポリン3の構造は実験的に決定されておらず、アミノ酸配列の相同性が高い他の水チャネルと同様に、水の通路が常に開いていると予測されていました。
今回、研究グループは、ナノディスク再構成法(用語4)を用いて、アクアポリン3を脂質に埋め込んだディスク粒子を作製し、クライオ電子顕微鏡単粒子解析法(用語5)により構造解析を行いました。その結果、水の通路の細胞外側にループ領域のチロシン残基が挿入され、通路がほぼ塞がれた構造をとることを発見しました。さらに、脂質二重膜中での分子動力学シミュレーション(用語6)によって、このチャネルが塞がれた状態が安定しており、水の透過性が極めて低いことが示されました。
また、アクアポリン3と同じ位置にチロシン残基を持つアクアポリン7についても、同様の条件下で構造解析を行いました。しかし、アクアポリン7では、チロシン残基を含むループが水の通路を塞ぐ構造はとられませんでした。この結果から、アクアポリン3に特有の構造である可能性が示されました。
本研究の成果は、アクアポリン3を標的とした医薬品開発において、構造情報を活用した創薬研究を加速することが期待されます。また、アクアポリン3の構造生理学的理解を深めるものです。
本成果は、3月20日付(現地時間)の「Nature Communications」誌に掲載されました。
[画像1]https://digitalpr.jp/simg/1706/106393/600_561_2025032116161467dd123ea6523.jpg
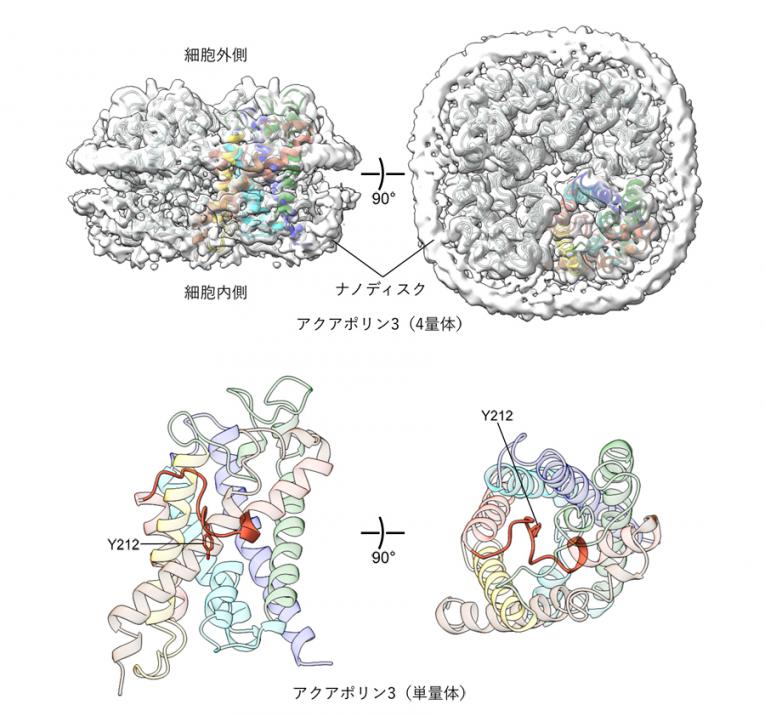
アクアポリン3のクライオ電子顕微鏡単粒子解析法によって得られたマップと構造モデル。アクアポリン3は4量体を形成する(上図)。水の通路は単量体ごとに一つ存在するが、その通路は細胞外側から、オレンジ色で示したループ領域のアミノ酸残基によってほぼ塞がれた構造をとることが解析された(下図)。また、水の通路に挿入されたチロシン残基(Y212)も示している(下図)。
研究背景
水チャネルは膜タンパク質であり、細胞膜によって隔てられた細胞内外の水移動を担います。水チャネルの中には、水だけでなくグリセロールや尿素などの小分子も輸送するサブタイプが存在し、アクアポリン3はこのサブタイプに分類されます。哺乳類では13種類の水チャネルが見つかっており、生体の水分管理に不可欠な役割を果たしています。具体的には、腎臓での尿濃縮、脳の水分調節、唾液や汗の分泌、肌の保湿などに関与しています。また、哺乳類に限らず、植物や原核生物を含むさまざまな生物種において、水チャネルをコードする遺伝子が同定されています。
水チャネルがどのようにして水や小分子を選択的に透過できるのかを解明するため、2000年頃から原子分解能の立体構造解析が進められ、多くの水チャネルの立体構造が明らかになってきました。そして、水チャネルは4量体を形成し、多くのものが単量体ごとに一つの水の通路を持つことが分かってきました。アクアポリン3とアミノ酸配列が類似する水チャネルとして、アクアポリン7、アクアポリン10、および大腸菌由来のGlpFの構造解析がすでに行われていました。しかし、アクアポリン3については、これまで構造が解析されていませんでした。
研究成果
本研究では、ラット由来のアミノ酸配列を持つアクアポリン3を昆虫細胞に大量発現させ、界面活性剤によって細胞膜を可溶化し、アクアポリン3を精製しました。その後、ナノディスク再構成法を用いて、アクアポリン3を脂質に埋め込んだディスク粒子を作製し、クライオ電子顕微鏡で撮影・構造解析を行いました。なお、藤吉研究室では、界面活性剤中のアクアポリン2についてクライオ電子顕微鏡単粒子解析法による構造解析を報告しています(参考文献1)。
解析の結果、アクアポリン3が4量体を構成していることが確認されました。さらに、アクアポリン3単量体のチャネル部分の構造を詳しく調べたところ、ループ領域に含まれるチロシン残基(Y212)が細胞外側から挿入され、チャネルをほぼ塞いでいることが明らかになりました(図1左)。このような構造は、これまでに報告された他の水チャネルでは見られず、新たな構造状態であると考えられます。分子動力学シミュレーションによる解析では、脂質二重膜に埋め込んだアクアポリン3の構造安定性や水透過性を計算した結果、チャネルが塞がれた構造は安定であり、水の透過が著しく低下していることが示されました。
さらに、アクアポリン3のチロシン残基(Y212)を、ヒドロキシ基を持たないが芳香環を有するフェニルアラニン残基に置換した変異体(Y212F)、および芳香環を持たないがヒドロキシ基を有するスレオニン残基に置換した変異体(Y212T)を作製し、同様のナノディスク再構成法による構造解析を行いました。その結果、チャネルを塞ぐ構造は、フェニルアラニン残基(Y212F)への置換でも維持されることが分かりました。
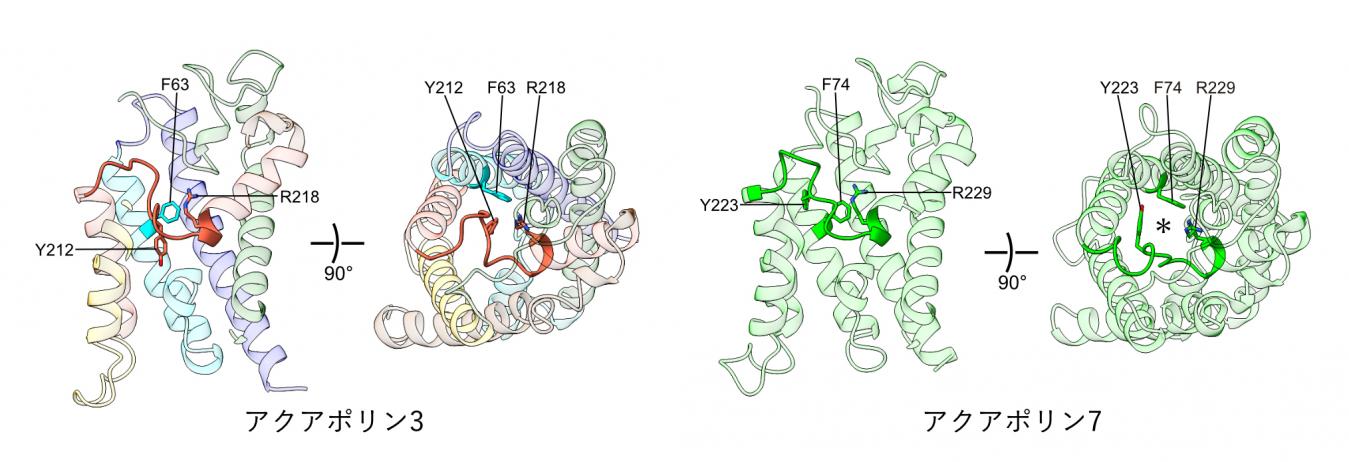
一方、ヒト由来のアクアポリン7は、アクアポリン3のチロシン残基(Y212)に相当する位置に同じチロシン残基(Y223)を持っています。そこで、アクアポリン7についてもナノディスク再構成法による構造解析を行いました。しかし、アクアポリン7では水の通路が塞がれることはなく、開いた構造をとっていました(図1右)。アクアポリン7では、チロシン残基(Y223)、フェニルアラニン残基(F74)、アルギニン残基(R229)がチャネルを囲む構造を形成していました(図1右)。アクアポリン3においても、同様の残基(Y212、F63、R218)が存在し(図1左)、これらの残基がチャネルを囲む構造をとると予想されていました。しかし、アクアポリン3では、Y212がチャネルを塞ぐ構造をとることが示されました。また、大腸菌由来のGlpFでは、アクアポリン3のチロシン残基(Y212)に相当する位置がフェニルアラニン残基(F200)になっています。そこで、GlpFについても同様の構造解析を行いましたが、GlpFのフェルアラニン残基はチャネルを塞ぐ構造をとりませんでした。以上の結果から、チャネルが細胞外側からチロシン残基によって塞がれる構造状態は、アクアポリン3に特有のものである可能性が示されました。
[画像2]https://digitalpr.jp/simg/1706/106393/600_205_2025032116173667dd1290ab56a.jpg
図1. アクアポリン3(左)とアクアポリン7(右)の構造モデルの比較
ナノディスク再構成法による単量体の構造モデルを、細胞膜断面方向および細胞外側から視点で表示している。細胞膜断面方向の表示では、Y212の挿入を見えやすくするために、手前側の構造モデルの一部を省略している。アクアポリン3では、水の通路をほぼ塞ぐループ領域をオレンジ色で示し、アクアポリン7において同様の位置にあるループ領域を緑色で示している。また、アクアポリン7における*は、水の通路の位置を示している。さらに、アクアポリン7のチャネルを囲む三つのアミノ酸残基(F74、Y223、R229)と、それに対応するアクアポリン3のアミノ酸残基(F63、Y212、R218)も示している。
社会的インパクト
アクアポリン3は、皮膚や腎臓の細胞、腸の上皮細胞、免疫系細胞などに発現が確認されており、水やグリセロール、過酸化水素の透過を担っていることが報告されています。そのため、これらの細胞や組織における水分調節や酸化ストレスバランスの調節機構を分子レベルで理解する上で、本研究によるアクアポリン3の構造生理学的知見が重要な貢献を果たすと期待されます。
また、アクアポリン3はがん細胞にも発現し、がん細胞の増殖や転移に関与することが報告されていることから、創薬標的としての可能性が考えられます。本研究で明らかにしたアクアポリン3の立体構造は、構造ベースの医薬品開発を加速させることが期待されます。
今後の展開
アクアポリン3のチャネルが細胞外側からほぼ塞がれた構造では、水の透過性が低下するため、チャネルの開閉機構が存在すると予想されます。また、アクアポリン3のみがこの閉じたチャネル構造をとることには、生理的な意義があると考えられます。そのため、今後の研究では、この開閉機構がどのように形成されるのか、その分子機序や生理的な役割の解明を目指しています。
さらに、基礎研究で用いられているアクアポリン3の阻害剤について、その結合構造を解析することで、阻害剤の研究開発に貢献することを目指します。
付記
この研究は、文部科学省科学研究費助成事業「基盤研究(A)」(20H00451)と日本医療研究開発機構(AMED)「次世代治療‧診断実現のための創薬基盤技術開発事業」(JP21ae0121028)、「創薬等先端技術支援基盤プラットフォーム(BINDS)」(JP24ama121023)の支援を受けて実施されました。
参考文献
[1]A. Kamegawa, S. Suzuki, H. Suzuki, K. Nishikawa, N. Numoto, Y. Fujiyoshi, Structural analysis of the water channel AQP2 by single-particle cryo-EM. J. Struct. Biol. 215, 107984 (2023). doi:10.1016/j.jsb.2023.107984
用語説明
(1)水チャネル:脂質二重膜によって隔てられた細胞内外の水輸送を担う膜タンパク質の総称。脂質部分を通じても水の移動は可能だが、水チャネルを介することで、より効率的に水を輸送できる。水チャネルの研究は、2003年にノーベル化学賞を受賞している。
(2)アクアポリン3:Aquaporin(AQP、アクアポリン)は遺伝子名であり、哺乳類では13種類同定されている。アクアポリン3はそのうちの一つであり、水に加えてグリセロールなどの小分子も透過することが知られている。
(2)立体構造解析:タンパク質は、アミノ酸がペプチド結合でつながることで構成されており、そのアミノ酸鎖がどのような3次元(立体)構造を形成しているのかを明らかにする手法。
(4)ナノディスク再構成法:界面活性剤によって精製した膜タンパク質を、ディスクを形成するベルト形成タンパク質と脂質と混合し、その後、界面活性剤を除去することで、脂質に囲まれた膜タンパク質の外側がベルト形成タンパク質で包まれたディスクを作製する方法。生体膜は脂質二重膜であるため、この手法により、生体内に近い環境で膜タンパク質を解析できる。
(5)クライオ電子顕微鏡単粒子解析法:2017年にノーベル化学賞を受賞した技術。本研究では、精製したアクアポリンを電子顕微鏡観察用グリッドに載せ、急速凍結によって氷包埋し、液体窒素温度付近に保持したまま透過型電子顕微鏡で撮影。得られたサンプルの投影像から3次元構造を再構成し、解析を行う手法。
(6)分子動力学シミュレーション:クライオ電子顕微鏡単粒子解析法で得られるタンパク質の立体構造は、凍結状態で撮影されたスナップショットである。一方で、タンパク質は動的に機能しているため、その動きを解析する手法として分子動力学シミュレーションが用いられる。コンピュータを用いて、タンパク質の原子モデルを初期構造とし、原子間力の計算と運動方程式による原子位置の更新を高速に繰り返すことで、タンパク質の動きをシミュレーションする。
論文情報
掲載誌:Nature Communications
論文タイトル:Narrowed pore conformations of aquaglyceroporins AQP3 and GlpF
著者:Daisuke Kozai, Masao Inoue, Shota Suzuki, Akiko Kamegawa, Kouki Nishikawa, Hiroshi Suzuki, Toru Ekimoto, Mitsunori Ikeguchi & Yoshinori Fujiyoshi
DOI:http://doi.org/10.1038/s41467-025-57728-3
研究者プロフィール
香西 大輔(コウザイ ダイスケ) Daisuke KOZAI
東京科学大学 総合研究院 高等研究府 細胞構造生理学研究室 プロジェクト助教
研究分野:構造生物化学
藤吉 好則(フジヨシ ヨシノリ) Yoshinori FUJIYOSHI
東京科学大学 総合研究院 高等研究府 細胞構造生理学研究室 特別栄誉教授
研究分野:構造生理学
井上 雅郎(イノウエ マサオ) Masao INOUE
横浜市立大学 大学院生命医科学研究科 生命情報科学研究室 特任助教
研究分野:分子シミュレーション
池口 満徳(イケグチ ミツノリ) Mitsunori IKEGUCHI
横浜市立大学 大学院生命医科学研究科 生命情報科学研究室 教授
研究分野:分子シミュレーション
プレスリリース詳細へ https://digitalpr.jp/r/106393
研究成果のポイント
水チャネルの一つであるAQP3(アクアポリン3)の立体構造を初めて解明。
水の通路が細胞外側のループ領域によって塞がれた新規のチャネル構造を発見。他の水チャネルでは報告されていない独自の構造的特徴を明らかに。
本研究の成果により、アクアポリン3を標的とする創薬研究の加速が期待される。
研究概要
東京科学大学(Science Tokyo)総合研究院 高等研究府 細胞構造生理学研究室の藤吉好則特別栄誉教授、香西大輔プロジェクト助教らは、横浜市立大学 大学院生命医科学研究科の池口満徳教授、井上雅郎特任助教らと共同で、細胞内外の水輸送に関与する膜タンパク質として知られる水チャネル(用語1)の一種であるアクアポリン3(用語2)の立体構造解析(用語3)を行いました。その結果、アクアポリン3は、これまで構造解析が行われた多くの水チャネルでは見られなかった、細胞外側から水の通路がほぼ塞がれたチャネル構造を持つことを発見しました。
これまで、アクアポリン3の構造は実験的に決定されておらず、アミノ酸配列の相同性が高い他の水チャネルと同様に、水の通路が常に開いていると予測されていました。
今回、研究グループは、ナノディスク再構成法(用語4)を用いて、アクアポリン3を脂質に埋め込んだディスク粒子を作製し、クライオ電子顕微鏡単粒子解析法(用語5)により構造解析を行いました。その結果、水の通路の細胞外側にループ領域のチロシン残基が挿入され、通路がほぼ塞がれた構造をとることを発見しました。さらに、脂質二重膜中での分子動力学シミュレーション(用語6)によって、このチャネルが塞がれた状態が安定しており、水の透過性が極めて低いことが示されました。
また、アクアポリン3と同じ位置にチロシン残基を持つアクアポリン7についても、同様の条件下で構造解析を行いました。しかし、アクアポリン7では、チロシン残基を含むループが水の通路を塞ぐ構造はとられませんでした。この結果から、アクアポリン3に特有の構造である可能性が示されました。
本研究の成果は、アクアポリン3を標的とした医薬品開発において、構造情報を活用した創薬研究を加速することが期待されます。また、アクアポリン3の構造生理学的理解を深めるものです。
本成果は、3月20日付(現地時間)の「Nature Communications」誌に掲載されました。
[画像1]https://digitalpr.jp/simg/1706/106393/600_561_2025032116161467dd123ea6523.jpg
アクアポリン3のクライオ電子顕微鏡単粒子解析法によって得られたマップと構造モデル。アクアポリン3は4量体を形成する(上図)。水の通路は単量体ごとに一つ存在するが、その通路は細胞外側から、オレンジ色で示したループ領域のアミノ酸残基によってほぼ塞がれた構造をとることが解析された(下図)。また、水の通路に挿入されたチロシン残基(Y212)も示している(下図)。
研究背景
水チャネルは膜タンパク質であり、細胞膜によって隔てられた細胞内外の水移動を担います。水チャネルの中には、水だけでなくグリセロールや尿素などの小分子も輸送するサブタイプが存在し、アクアポリン3はこのサブタイプに分類されます。哺乳類では13種類の水チャネルが見つかっており、生体の水分管理に不可欠な役割を果たしています。具体的には、腎臓での尿濃縮、脳の水分調節、唾液や汗の分泌、肌の保湿などに関与しています。また、哺乳類に限らず、植物や原核生物を含むさまざまな生物種において、水チャネルをコードする遺伝子が同定されています。
水チャネルがどのようにして水や小分子を選択的に透過できるのかを解明するため、2000年頃から原子分解能の立体構造解析が進められ、多くの水チャネルの立体構造が明らかになってきました。そして、水チャネルは4量体を形成し、多くのものが単量体ごとに一つの水の通路を持つことが分かってきました。アクアポリン3とアミノ酸配列が類似する水チャネルとして、アクアポリン7、アクアポリン10、および大腸菌由来のGlpFの構造解析がすでに行われていました。しかし、アクアポリン3については、これまで構造が解析されていませんでした。
研究成果
本研究では、ラット由来のアミノ酸配列を持つアクアポリン3を昆虫細胞に大量発現させ、界面活性剤によって細胞膜を可溶化し、アクアポリン3を精製しました。その後、ナノディスク再構成法を用いて、アクアポリン3を脂質に埋め込んだディスク粒子を作製し、クライオ電子顕微鏡で撮影・構造解析を行いました。なお、藤吉研究室では、界面活性剤中のアクアポリン2についてクライオ電子顕微鏡単粒子解析法による構造解析を報告しています(参考文献1)。
解析の結果、アクアポリン3が4量体を構成していることが確認されました。さらに、アクアポリン3単量体のチャネル部分の構造を詳しく調べたところ、ループ領域に含まれるチロシン残基(Y212)が細胞外側から挿入され、チャネルをほぼ塞いでいることが明らかになりました(図1左)。このような構造は、これまでに報告された他の水チャネルでは見られず、新たな構造状態であると考えられます。分子動力学シミュレーションによる解析では、脂質二重膜に埋め込んだアクアポリン3の構造安定性や水透過性を計算した結果、チャネルが塞がれた構造は安定であり、水の透過が著しく低下していることが示されました。
さらに、アクアポリン3のチロシン残基(Y212)を、ヒドロキシ基を持たないが芳香環を有するフェニルアラニン残基に置換した変異体(Y212F)、および芳香環を持たないがヒドロキシ基を有するスレオニン残基に置換した変異体(Y212T)を作製し、同様のナノディスク再構成法による構造解析を行いました。その結果、チャネルを塞ぐ構造は、フェニルアラニン残基(Y212F)への置換でも維持されることが分かりました。
一方、ヒト由来のアクアポリン7は、アクアポリン3のチロシン残基(Y212)に相当する位置に同じチロシン残基(Y223)を持っています。そこで、アクアポリン7についてもナノディスク再構成法による構造解析を行いました。しかし、アクアポリン7では水の通路が塞がれることはなく、開いた構造をとっていました(図1右)。アクアポリン7では、チロシン残基(Y223)、フェニルアラニン残基(F74)、アルギニン残基(R229)がチャネルを囲む構造を形成していました(図1右)。アクアポリン3においても、同様の残基(Y212、F63、R218)が存在し(図1左)、これらの残基がチャネルを囲む構造をとると予想されていました。しかし、アクアポリン3では、Y212がチャネルを塞ぐ構造をとることが示されました。また、大腸菌由来のGlpFでは、アクアポリン3のチロシン残基(Y212)に相当する位置がフェニルアラニン残基(F200)になっています。そこで、GlpFについても同様の構造解析を行いましたが、GlpFのフェルアラニン残基はチャネルを塞ぐ構造をとりませんでした。以上の結果から、チャネルが細胞外側からチロシン残基によって塞がれる構造状態は、アクアポリン3に特有のものである可能性が示されました。
[画像2]https://digitalpr.jp/simg/1706/106393/600_205_2025032116173667dd1290ab56a.jpg
図1. アクアポリン3(左)とアクアポリン7(右)の構造モデルの比較
ナノディスク再構成法による単量体の構造モデルを、細胞膜断面方向および細胞外側から視点で表示している。細胞膜断面方向の表示では、Y212の挿入を見えやすくするために、手前側の構造モデルの一部を省略している。アクアポリン3では、水の通路をほぼ塞ぐループ領域をオレンジ色で示し、アクアポリン7において同様の位置にあるループ領域を緑色で示している。また、アクアポリン7における*は、水の通路の位置を示している。さらに、アクアポリン7のチャネルを囲む三つのアミノ酸残基(F74、Y223、R229)と、それに対応するアクアポリン3のアミノ酸残基(F63、Y212、R218)も示している。
社会的インパクト
アクアポリン3は、皮膚や腎臓の細胞、腸の上皮細胞、免疫系細胞などに発現が確認されており、水やグリセロール、過酸化水素の透過を担っていることが報告されています。そのため、これらの細胞や組織における水分調節や酸化ストレスバランスの調節機構を分子レベルで理解する上で、本研究によるアクアポリン3の構造生理学的知見が重要な貢献を果たすと期待されます。
また、アクアポリン3はがん細胞にも発現し、がん細胞の増殖や転移に関与することが報告されていることから、創薬標的としての可能性が考えられます。本研究で明らかにしたアクアポリン3の立体構造は、構造ベースの医薬品開発を加速させることが期待されます。
今後の展開
アクアポリン3のチャネルが細胞外側からほぼ塞がれた構造では、水の透過性が低下するため、チャネルの開閉機構が存在すると予想されます。また、アクアポリン3のみがこの閉じたチャネル構造をとることには、生理的な意義があると考えられます。そのため、今後の研究では、この開閉機構がどのように形成されるのか、その分子機序や生理的な役割の解明を目指しています。
さらに、基礎研究で用いられているアクアポリン3の阻害剤について、その結合構造を解析することで、阻害剤の研究開発に貢献することを目指します。
付記
この研究は、文部科学省科学研究費助成事業「基盤研究(A)」(20H00451)と日本医療研究開発機構(AMED)「次世代治療‧診断実現のための創薬基盤技術開発事業」(JP21ae0121028)、「創薬等先端技術支援基盤プラットフォーム(BINDS)」(JP24ama121023)の支援を受けて実施されました。
参考文献
[1]A. Kamegawa, S. Suzuki, H. Suzuki, K. Nishikawa, N. Numoto, Y. Fujiyoshi, Structural analysis of the water channel AQP2 by single-particle cryo-EM. J. Struct. Biol. 215, 107984 (2023). doi:10.1016/j.jsb.2023.107984
用語説明
(1)水チャネル:脂質二重膜によって隔てられた細胞内外の水輸送を担う膜タンパク質の総称。脂質部分を通じても水の移動は可能だが、水チャネルを介することで、より効率的に水を輸送できる。水チャネルの研究は、2003年にノーベル化学賞を受賞している。
(2)アクアポリン3:Aquaporin(AQP、アクアポリン)は遺伝子名であり、哺乳類では13種類同定されている。アクアポリン3はそのうちの一つであり、水に加えてグリセロールなどの小分子も透過することが知られている。
(2)立体構造解析:タンパク質は、アミノ酸がペプチド結合でつながることで構成されており、そのアミノ酸鎖がどのような3次元(立体)構造を形成しているのかを明らかにする手法。
(4)ナノディスク再構成法:界面活性剤によって精製した膜タンパク質を、ディスクを形成するベルト形成タンパク質と脂質と混合し、その後、界面活性剤を除去することで、脂質に囲まれた膜タンパク質の外側がベルト形成タンパク質で包まれたディスクを作製する方法。生体膜は脂質二重膜であるため、この手法により、生体内に近い環境で膜タンパク質を解析できる。
(5)クライオ電子顕微鏡単粒子解析法:2017年にノーベル化学賞を受賞した技術。本研究では、精製したアクアポリンを電子顕微鏡観察用グリッドに載せ、急速凍結によって氷包埋し、液体窒素温度付近に保持したまま透過型電子顕微鏡で撮影。得られたサンプルの投影像から3次元構造を再構成し、解析を行う手法。
(6)分子動力学シミュレーション:クライオ電子顕微鏡単粒子解析法で得られるタンパク質の立体構造は、凍結状態で撮影されたスナップショットである。一方で、タンパク質は動的に機能しているため、その動きを解析する手法として分子動力学シミュレーションが用いられる。コンピュータを用いて、タンパク質の原子モデルを初期構造とし、原子間力の計算と運動方程式による原子位置の更新を高速に繰り返すことで、タンパク質の動きをシミュレーションする。
論文情報
掲載誌:Nature Communications
論文タイトル:Narrowed pore conformations of aquaglyceroporins AQP3 and GlpF
著者:Daisuke Kozai, Masao Inoue, Shota Suzuki, Akiko Kamegawa, Kouki Nishikawa, Hiroshi Suzuki, Toru Ekimoto, Mitsunori Ikeguchi & Yoshinori Fujiyoshi
DOI:http://doi.org/10.1038/s41467-025-57728-3
研究者プロフィール
香西 大輔(コウザイ ダイスケ) Daisuke KOZAI
東京科学大学 総合研究院 高等研究府 細胞構造生理学研究室 プロジェクト助教
研究分野:構造生物化学
藤吉 好則(フジヨシ ヨシノリ) Yoshinori FUJIYOSHI
東京科学大学 総合研究院 高等研究府 細胞構造生理学研究室 特別栄誉教授
研究分野:構造生理学
井上 雅郎(イノウエ マサオ) Masao INOUE
横浜市立大学 大学院生命医科学研究科 生命情報科学研究室 特任助教
研究分野:分子シミュレーション
池口 満徳(イケグチ ミツノリ) Mitsunori IKEGUCHI
横浜市立大学 大学院生命医科学研究科 生命情報科学研究室 教授
研究分野:分子シミュレーション
プレスリリース詳細へ https://digitalpr.jp/r/106393