病原細菌であるレジオネラが宿主細胞の小胞体に定着する仕組みを解明~レジオネラの小胞体定着化に働く宿主・病原体双方の因子を発見
【ポイント】
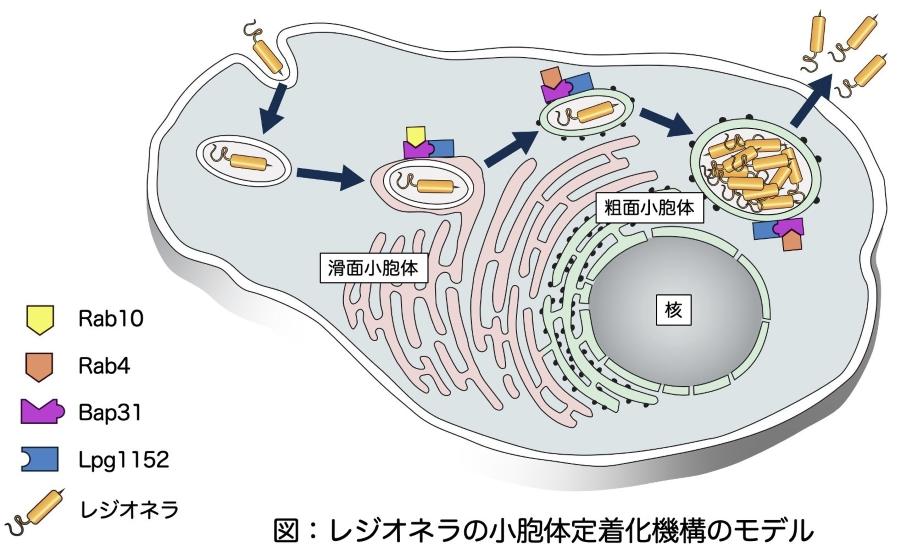
■ 宿主細胞の小胞体に到達したレジオネラは、滑面小胞体より侵入し粗面小胞体へと移行することで小胞体内に増殖ニッチを形成していることを発見しました。
■ レジオネラが滑面小胞体から粗面小胞体へと移行する過程において、宿主細胞に備わっているRab4やRab10及びBap31を階層的に利用していることを見出し、レジオネラが分泌するLpg1152と呼ばれる病原因子がBap31の機能をハイジャックすることを発見しました。
■ これらの成果は、レジオネラの小胞体定着化の抑制などを基盤としたレジオネラ感染に対する新規治療法の開発に繋げられることが期待されます。
【概要】
東京薬科大学・生命科学部・感染制御学研究室の新崎恒平教授らは、カリフォルニア大学サンフランシスコ校のShaeri Mukherjee教授らの研究グループとの共同研究により、病原細菌であるレジオネラが宿主細胞内の小胞体に定着する仕組みを解明しました。本研究の成果は、レジオネラの細胞内発症機構の一旦を明らかにしたとともに、この仕組みの抑制を基盤としたレジオネラ感染における新規治療法の確立に繋げられることが期待されます。本成果は、2024年12月12日に米国Cell Pressが刊行するオンライン科学誌「Cell Reports」に掲載されました。
【研究の背景】
温泉や公衆浴場など『水』を扱う施設での感染事例を報道などで目にする機会のあるレジオネラですが、感染に伴い重篤な肺炎を引き起こすことが知られています。また、レジオネラは宿主細胞内で増殖することから、「細胞内発症型細菌」となります。
宿主細胞であるマクロファージ(食細胞)に侵入後、レジオネラはレジオネラ含有液胞(Legionella-containing vacuole; LCV)とよばれる膜構造を細胞内に形成します。通常、マクロファージは細胞外の異物を取り込みリソソーム(細胞内の分解工場)へ輸送した後に分解する役割を担っていますが、レジオネラはLCVがリソソームへと輸送される過程を遮断します。更には、宿主細胞の小胞体より分泌された輸送小胞をLCVへと取り込むことでLCVの構造を変換します。そして、この変換が引き金となりLCVは小胞体へ移行し、レジオネラは最終的に小胞体で増殖します。なお、上記したレジオネラによる細胞内感染の成立には、レジオネラが宿主細胞に対して分泌する病原因子である「レジオネラエフェクター」が必要不可欠です。
レジオネラが増殖する場である小胞体には、「滑面小胞体」・「粗面小胞体」・「他の細胞小器官との接触場」といった複数のマイクロドメインが存在することが知られていますが、「LCVは小胞体のどのドメインと結合するか?」・「レジオネラは小胞体のどのドメインで増殖するか?」など不明な点も残されていました。
【研究成果の詳細】
本研究では、各種小胞体のマイクロドメインと小胞体に到達したレジオネラの挙動との関連を調べるところから着手しました。その結果、レジオネラは、1滑面小胞体を介して小胞体に侵入する、2滑面小胞体から粗面小胞体へと移動して増殖することを見出しました。また、LCVと滑面小胞体との安定的な接触にRab10(宿主因子)が必要であること、一方、滑面小胞体から粗面小胞体への移行にRab4(宿主因子)が重要な役割を担っていることを明らかにしました。
続いて、Bap31(宿主因子)の機能に着目して研究を行いました。Bap31は小胞体に存在し、滑面小胞体と粗面小胞体を循環することで小胞体内での物質移動を媒介することが知られているタンパク質です。そこで、レジオネラの滑面小胞体から粗面小胞体への移行におけるBap31の働きを調べたところ、滑面小胞体に到達したレジオネラの周辺にBap31が供給されること、Bap31を欠損させた細胞に感染したレジオネラは滑面小胞体から粗面小胞体への移動できず増殖が著しく抑制されることが明らかとなりました。
【研究の背景】の項にて記載した通り、レジオネラの細胞内感染の成立にはレジオネラが宿主細胞に対して放出する『レジオネラエフェクター』の機能が必要不可欠となります。そこで、レジオネラエフェクターが放出できない変異株におけるBap31の動体を解析しました。その結果、当該変異株の周辺にはBap31が集積しないことが分かりました。このことは、レジオネラはレジオネラエフェクターを用いてBap31を自身の周辺に供給していることを意味しています。そこで、Bap31を制御するレジオネラエフェクターの探索を行い、Lpg1152というレジオネラエフェクターがBap31と結合することでその機能を制御することを発見しました。重要なポイントとして、Lpg1152を欠損させたレジオネラ株は滑面小胞体から粗面小胞体へと移行できず細胞内増殖能も減衰していました。以上の結果は、小胞体に到達したレジオネラは滑面小胞体から粗面小胞体へと移動し、粗面小胞体において複製ニッチを形成していることを示しています。
【今後の展望】
現在、レジオネラを含む多くの病原菌感染症の治療は抗生物質の処方が主流となっています。しかしながら、多くの抗生物質に耐性を示す病原菌の蔓延が懸念されている現状において、抗生物質に頼らない病原菌感染症の治療法の確立が世界規模で急務となっています。それゆえ、細胞内に侵入した病原菌の振る舞いを理解することは、その振る舞いを制御することによる増殖抑制といった病原菌感染症に対する新たな治療法となる可能性が秘められています。今回の研究では、レジオネラの宿主小胞体定着化の分子メカニズムを明らかにしましたが、この定着化を阻害できる薬剤によるレジオネラの細胞内増殖への効果やレジオネラ感染症への治療薬となりうるかなどを検証したいと考えています。
【用語解説】
レジオネラ:1976年、米国フィラデルフィア州で開催された在郷軍人会に参加していた複数の人々が肺炎を発症し、患者より新規の病原細菌が単離された。その後、在郷軍人(legionnaire)にちなみ、Legionella pneumophila(レジオネラ・ニューモフィラ)と命名された。自然界において、レジオネラはアメーバなどの原生生物を宿主としているが、レジオネラを含むアメーバなどによって形成されたバイオフィル(例:排水溝のヌメリ)が存在する取水管やタンク内の水はレジオネラによって汚染される。そして、それら水源から発生するエアロゾルの吸入がヒトへの感染の引き金となる。このように、「水」がキーワードとなる場所でレジオネラが繁殖しやすいことから、日本においては『温泉』や『公衆浴場』などでレジオネラによる集団感染が発生しやすい。
レジオネラエフェクター:細胞内に侵入したレジオネラが、分泌装置(注射器のようなもの)を介して宿主細胞内に放出する病原因子。これまでの研究により、レジオネラは300種類以上のレジオネラエフェクターを放出していると推測されている。レジオネラエフェクターの一つ一つに宿主細胞の機能をコントロールする役割があると考えられているが、多くのレジオネラエフェクターが機能未知となっている。
小胞体:細胞内で最も大きい細胞小器官であり、脂質合成やカルシウムイオンの貯蔵に関わる滑面小胞体とタンパク質合成の場であるリボソームが付着した粗面小胞体の二つの区画に大別される。最近の研究によって、小胞体はその他の細胞小器官と物理的に接触し、その接触場が重要な生理機能の足場となっていることが分かりつつある。
Rabタンパク質:低分子量GTPアーゼ(GDPが結合した不活性化型とGTPが結合した活性化型をサイクルすることで細胞内生理機能を制御する分子スイッチ)とよばれる酵素群に分類されるタンパク質であり、宿主細胞に約64の分子種が存在すると考えられている。細胞内における物質輸送の特異性の担保に重要な役割を担っている。
【原著論文】
掲載誌:Cell Reports
論文名:Legionella uses host Rab GTPases and BAP31 to create a unique ER niche.
著者:Attinder Chadha1,2,*, 野内 優4, 生出 紘夢4, 若菜 裕一4, 井上 弘樹4, Saradindu Saha1,2, Manish Paul1,2, 多賀谷 光男4, 新崎 恒平4,*,# Shaeri Mukherjee1,2,3,#
*:同貢献度 #:責任著者
所属:1 G.W. Hooper Foundation, University of California at San Francisco 2 Department of Microbiology and Immunology, University of California at San Francisco 3 Chan Zuckerberg Biohub 4 東京薬科大学・生命科学部
DOI: 10.1016/j.celrep.2024.115053
【研究支援】
日本学術振興会 科学研究費助成事業 若手研究B( 24790425)、若手研究A(26713016)、基盤研究B(18H02656)、学術変革領域研究B(20H05772)(研究代表者:新崎恒平)
上原記念生命科学財団(研究代表者:新崎恒平)
内藤記念科学振興財団(研究代表者:新崎恒平)
武田科学振興財団(研究代表者:新崎恒平)
アステラス病態代謝研究会(研究代表者:新崎恒平)
▼本件に関する問い合わせ先
入試・広報センター
住所:東京都八王子市堀之内1432-1
TEL:042-676-4921
FAX:042-676-8961
メール:kouhouka@toyaku.ac.jp
【リリース発信元】 大学プレスセンター https://www.u-presscenter.jp/
プレスリリース詳細へ https://digitalpr.jp/r/101245